题目内容
3.98g H2SO4的摩尔质量是98g/mol其物质的量为1mol,若有2mol H2SO4的质量是196g,其中含有4 mol H,含有8 molO.分析 摩尔质量以g/mol为单位,数值上等于其相对分子质量,根据n=$\frac{m}{M}$计算硫酸的物质的量,氧原子物质的量为硫酸的4倍,H的物质的量为硫酸的2倍,根据m=nM计算H的质量.
解答 解:H2SO4的摩尔质量为98g/mol,所以98g H2SO4的物质的量为1mol,2mol H2SO4的质量是2×98=196g,其中含有4 mol H,含有 8 molO,故答案为:98g/mol;1mol;196g;4;8.
点评 本题考查物质的量有关计算,比较基础,旨在考查学生对基础知识的巩固,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案
相关题目
6. 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )
 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )| A. | 原氨水浓度x=0.01mol•L-1 | |
| B. | m、p两点溶液中由水电离出来的c(OH-):m>p | |
| C. | n点溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 若在m点溶液中加少量水,[c(NH3•H2O)•c(H+)]/c(NH4+)不变 |
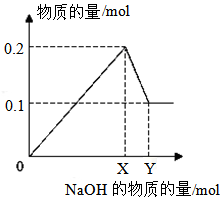
18.已知(NH4)2SO4+2NaOH=Na2SO4+2NH3•H2O,现将400mLMgCl2、K2SO4、(NH4)2SO4的混合溶液分成两等份,取一份加入含amolBaCl2的溶液,刚好使SO42-沉淀完全,继续加入含bmolAgNO3的溶液,刚好使Cl-沉淀完全,另取一份加入含cmolNaOH的溶液,恰好完全反应,则该溶液中K+浓度为( )
| A. | 5(b+2a-c) | B. | $\frac{5(2b-c)}{3}$ | C. | $\frac{5(2b-a+c)}{3}$ | D. | 5(b-c) |
 I.20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度为0.2mol/L,Ba2+的物质的量为0.002mol.
I.20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度为0.2mol/L,Ba2+的物质的量为0.002mol.