题目内容
20.将36mLKBr和KI的混合溶液分为两等份.向其中一份通入足量的Cl2,完全反应后蒸发至干,灼烧所得物质,得到6.1g固体残留物.测得另一份混合液中I-的浓度为0.86mol•L-1.(1)固体残留物中含有什么物质?
(2)原溶液中含有KBr的质量是多少?
(3)反应完全时消耗Cl2的体积是多少(标准状况)?
分析 (1)发生反应:2KBr+Cl2=2KCl+Br2、2KI+Cl2=2KCl+I2,氯气足量,KBr、KI完全反应,加热蒸发、灼烧,Br2挥发,I2升华,最终得到的固体为KCl;
(2)根据n=$\frac{m}{M}$计算KCl的物质的量,根据n=cV计算KI的物质的量,由K元素守恒可知,n(KBr)+n(KI)=n(KCl),再根据m=nM计算KBr的质量;
(3)根据氯元素守恒n(Cl)=$\frac{1}{2}$n(Cl2)=n(KCl),据此求消耗氯气的体积;
解答 解:(1)发生反应:2KBr+Cl2=2KCl+Br2、2KI+Cl2=2KCl+I2,氯气足量,KBr、KI完全反应,加热蒸发、灼烧,Br2挥发,I2升华,最终得到的固体为KCl,
答:固体残留物中含有KCl;
(2)KCl的物质的量=$\frac{6.1g}{74.5g/mol}$×2=0.16mol,KI的物质的量=2×0.036L×0.86mol/L=0.062mol,由K元素守恒可知:n(KBr)=n(KCl)-n(KI)=0.16mol-0.062mol=0.098mol,故m(KBr)=0.098mol×119g/mol=11.7g,
答:原溶液中含有KBr的质量为11.7g;
(3)根据氯元素守恒n(Cl)=$\frac{1}{2}$n(Cl2)=n(KCl),则n(Cl2)=2n(KCl)=2×0.16mol=0.32mol,V(Cl2)=n(Cl2)×Vm=0.32mol×22.4L/mol=7.168L.
答:反应完全时消耗Cl2的体积是7.168L.
点评 本题考查化学方程式的计算、混合物计算,难度不大,判断蒸发灼烧后的固体成分是解题关键.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
10.下列说法正确的是( )
①参加反应的物质本身的性质是影响化学反应速率的主要因素
②光是影响某些化学反应速率的外界条件之一
③决定化学反应速率的主要因素是浓度
④不管什么反应,增大浓度、加热、加压、使用催化剂都可以加快反应速率.
①参加反应的物质本身的性质是影响化学反应速率的主要因素
②光是影响某些化学反应速率的外界条件之一
③决定化学反应速率的主要因素是浓度
④不管什么反应,增大浓度、加热、加压、使用催化剂都可以加快反应速率.
| A. | ①② | B. | ②③ | C. | ④ | D. | ①④ |
5.下列关于铵盐的叙述中正确的是( )
①所有铵盐都有氨的刺激性气味
②所有铵盐都溶于水
③铵盐不稳定,受热易分解
④铵盐能与碱反应,受热放出氨气
⑤铵盐都不能与酸反应.
①所有铵盐都有氨的刺激性气味
②所有铵盐都溶于水
③铵盐不稳定,受热易分解
④铵盐能与碱反应,受热放出氨气
⑤铵盐都不能与酸反应.
| A. | ①③④ | B. | ②③④ | C. | ①②③④ | D. | ①②③④⑤ |
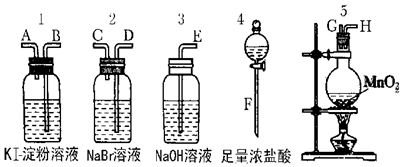
 I.20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度为0.2mol/L,Ba2+的物质的量为0.002mol.
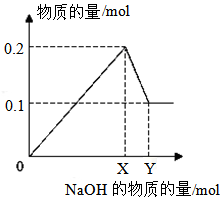
I.20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度为0.2mol/L,Ba2+的物质的量为0.002mol.

 .A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示)
.A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示) _.
_.