题目内容
2.压强变化不会使下列化学反应的平衡发生移动的是( )| A. | H2(g)+Br2(g)?2HBr(g) | B. | N2(g)+3H2(g)?2NH3(g) | C. | 2SO2(g)+O2(g)?2SO3(g) | D. | C(s)+CO2(g)?2CO(g) |
分析 有气体参加反应,且反应前后气体的体积不变的化学反应,改变压强能同等程度改变正逆反应速率,平衡不移动,以此解答该题.
解答 解:题中B、C、D反应前后气体的体积不等,改变压强平衡发生移动,而A反应前后气体的体积不变,改变压强平衡不移动,
故选A.
点评 本题考查压强对平衡移动的影响,为高频考点,侧重考查学生的分析能力,题目难度不大,明确反应前后气体的体积关系是解答该题的关键.

练习册系列答案
相关题目
5.下列除去杂质的方法正确的是( )
| A. | 除去乙烷中少量的乙烯:气体通过盛酸性高锰酸钾溶液的洗气瓶 | |
| B. | 除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤、分液、干燥、蒸馏 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 | |
| D. | 除去乙醇中少量的乙酸:加足量生石灰、蒸馏 |
6. 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )
 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )| A. | 原氨水浓度x=0.01mol•L-1 | |
| B. | m、p两点溶液中由水电离出来的c(OH-):m>p | |
| C. | n点溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 若在m点溶液中加少量水,[c(NH3•H2O)•c(H+)]/c(NH4+)不变 |
10.下列说法正确的是( )
①参加反应的物质本身的性质是影响化学反应速率的主要因素
②光是影响某些化学反应速率的外界条件之一
③决定化学反应速率的主要因素是浓度
④不管什么反应,增大浓度、加热、加压、使用催化剂都可以加快反应速率.
①参加反应的物质本身的性质是影响化学反应速率的主要因素
②光是影响某些化学反应速率的外界条件之一
③决定化学反应速率的主要因素是浓度
④不管什么反应,增大浓度、加热、加压、使用催化剂都可以加快反应速率.
| A. | ①② | B. | ②③ | C. | ④ | D. | ①④ |
17.NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 6.4g铜在足量的氯气中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,2.24L乙醇中含有的氧原子数为0.1NA | |
| C. | 2.0gH218O与D216O的混合物中所含质子数为NA | |
| D. | 0.1L0.5 mol•L-1CH3COOH溶液中含有的H+数为0.05NA |
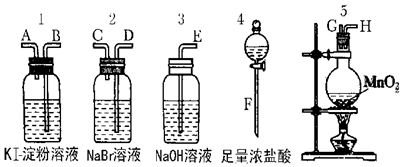
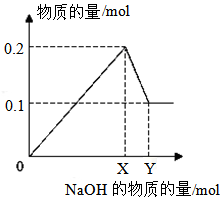 I.20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度为0.2mol/L,Ba2+的物质的量为0.002mol.
I.20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度为0.2mol/L,Ba2+的物质的量为0.002mol.