题目内容
18.如表是短元素周期表的一部分.| … | ① | ② | ③ | |
| … | ④ | ⑤ |
(2)科学家通过对①~⑤元素的化合物进行研究,从而寻找a(选填序号).
a.高效农药 b.催化剂
c.耐高温、耐腐蚀的合金材料 d.半导体材料
(3)研究①~⑤元素的气态氢化物(用化学符号回答):②的气态氢化物的电子式
 .
.(4)④和⑤的元素最高价氧化物对应水化物的酸性较强的物质的化学式H2SO4.
分析 由元素在短周期中的位置可知,①为C、②为N、③为O、④为P、⑤为S,
(1)电子层数=周期数,最外层电子数=族序数;
(2)①~⑤元素均为非金属元素;
(3)②的气态氢化物为氨气;
(4)非金属性越强,元素最高价氧化物对应水化物的酸性越强.
解答 解:由元素在短周期中的位置可知,①为C、②为N、③为O、④为P、⑤为S,
(1)电子层数=周期数,最外层电子数=族序数,则从原子结构角度分析,①、②、③三种元素的电子层数相同,②、④位于元素周期表的第ⅤA族,
故答案为:电子层数;ⅤA;
(2)①~⑤元素均为非金属元素,可寻找高效农药的元素,而催化剂、耐高温、耐腐蚀的合金材料均为金属元素,半导体材料在金属与非金属的交界处,
故答案为:a;
(3)②的气态氢化物为氨气,其电子式为 ,故答案为:
,故答案为: ;
;
(4)非金属性S>P,元素最高价氧化物对应水化物的酸性较强的物质的化学式为H2SO4,故答案为:H2SO4.
点评 本题考查位置、结构、性质,为高频考点,把握元素的位置、性质、原子结构为解答的关键,侧重分析与应用能力的考查,注意原子结构与元素位置的关系,题目难度不大.

练习册系列答案
相关题目
6.航天领域中常用N2H4与N2O4作为火箭发射的燃料与助燃剂.N2O4是一种无色气体,易分解:N2O4(g)?2NO2(g)-Q.N2H4与氨气相似,是一种碱性气体,易溶于水,生成弱碱N2H4•H2O.t℃时,将一定量的NO2、N2O4充入一个容积为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
(1)前10min内用NO2表示的反应速率为0.04mol•L-1•min-1;该反应的平衡常数表达式K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$.
(2)20min时改变的条件是向容器中加入0.8molNO2;重新达到平衡时,NO2的体积分数B(填字母)
A.增大B.减小C.不变D.无法判断
(3)用电离方程式表示N2H4•H2O显碱性的原因N2H4•H2O?N2H5++OH-(或N2H4+H2O?N2H5++OH-).
(4)相同条件下,1mol N2H4最多能与2mol HCl发生反应.
(5)常温下,若将0.2mol/LN2H4•H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H${\;}_{5}^{+}$、Cl-、OH-、H+四种离子浓度由大到小的顺序为c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
(提示:相同条件下,N2H4•H2O的电离程度大于N2H5Cl的水解程度.)
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/mol/L | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/mol/L | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
(2)20min时改变的条件是向容器中加入0.8molNO2;重新达到平衡时,NO2的体积分数B(填字母)
A.增大B.减小C.不变D.无法判断
(3)用电离方程式表示N2H4•H2O显碱性的原因N2H4•H2O?N2H5++OH-(或N2H4+H2O?N2H5++OH-).
(4)相同条件下,1mol N2H4最多能与2mol HCl发生反应.
(5)常温下,若将0.2mol/LN2H4•H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H${\;}_{5}^{+}$、Cl-、OH-、H+四种离子浓度由大到小的顺序为c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
(提示:相同条件下,N2H4•H2O的电离程度大于N2H5Cl的水解程度.)
3.如表为元素周期表的一部分按要求完成各小题.
(1)化学性质最不活泼的元素Ar(填化学式,下同),非金属性最强的元素是F,金属性最强的单质与水反应的化学方程式为2K+2H2O=2KOH+H2↑
(2)①③⑤三种元素的最高价氧化物的水化物中,碱性最强的是NaOH
(3)元素⑤的最高价氧化物为两性氧化物(填酸性、碱性或两性氧化物),该最高价氧化物与氢氧化钠反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O;向该元素和⑨号元素组成的化合物溶液中,缓缓滴加氢氧化钠溶液至过量,现象为先生成白色沉淀,后沉淀溶解.
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | ⑥ | ⑦ | ⑧ | |||||
| 3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
| 4 | ② | ④ |
(2)①③⑤三种元素的最高价氧化物的水化物中,碱性最强的是NaOH
(3)元素⑤的最高价氧化物为两性氧化物(填酸性、碱性或两性氧化物),该最高价氧化物与氢氧化钠反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O;向该元素和⑨号元素组成的化合物溶液中,缓缓滴加氢氧化钠溶液至过量,现象为先生成白色沉淀,后沉淀溶解.
7.将xmol/LH2SO4溶液aml稀释到bL,稀释后溶液的H+物质的量浓度为( )
| A. | ax/100bmol/L | B. | ax/500bmol/L | C. | ax/2000bmol/L |
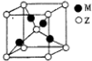 X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的s电子数比p电子数多3个,
X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的s电子数比p电子数多3个, .
.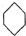 (g)?3H2(g)+
(g)?3H2(g)+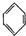 (g)△H1
(g)△H1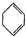 (g)△H2=+28.6KJ/mol
(g)△H2=+28.6KJ/mol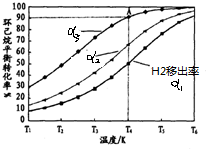
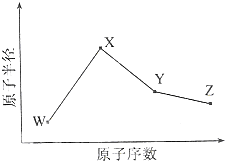 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.