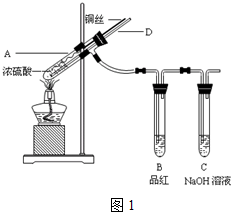
题目内容
1.硫酸是重要的工业原料.工业上生产硫酸主要分为造气、催化氧化、吸收三个阶段,其生产流程图如下: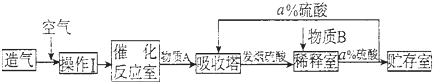
(1)操作I的内容是净化、干燥除去有害成分,此操作目的是防止催化剂中毒.物质B是H2O.a=98.
(2)工业上既可用硫黄也可用硫铁矿(FeS2)造气,若使用硫铁矿造气.另一产物是一种常见的红棕色固体.写出用硫铁矿造气时反应的化学方程式4FeS2+1102$\frac{\underline{\;高温\;}}{\;}$8SO2+2Fe203.
(3)催化反应室中的反应是一个气体体积缩小的反应.增大压强有利于反应向右进行.但实际生产却是在常压下进行的.原因是常压下SO2转化为SO3的转化率已很大
(4)工业生产中常用氨一硫酸法进行尾气脱硫,以达到消除污染、废物利用的目的.用两个化学方程式表示其反应原理SO2+2NH3•H2O═(NH4)2SO3,(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O
(5)若用等质量的硫黄、FeS2生产硫酸.假设原料的总利用率均为90%.则二者得到硫酸的质量比为15:8.
分析 工业上生产硫酸主要分为造气、催化氧化、吸收三个阶段,造气主要用硫铁矿(FeS2)与氧气在高温条件下反应生成二氧化硫气体,生成的二氧化硫气体再与经过净化、干燥除去有害成分的空气一起通到催化反应室进行催化氧化生成三氧化硫,最后再用98%的硫酸溶液吸收三氧化硫制得发烟硫酸,再加水稀释得到浓硫酸;
(1)根据以上分析,二氧化硫催化氧化生成三氧化硫需要催化剂,而催化剂又要注意不能中毒失效,吸收塔用98%的硫酸溶液吸收三氧化硫制得发烟硫酸,再加水稀释得到浓硫酸,据此分析;
(2)根据以上分析,造气主要用硫铁矿(FeS2)与氧气在高温条件下反应生成二氧化硫气体和红棕色固体三氧化二铁,据此书写硫铁矿造气时反应的化学方程式;
(3)根据工业生产经济化结合常压下SO2转化为SO3的转化率已很大分析;
(4)工业生产中常用氨-酸法进行尾气脱硫,即先用氨水吸收二氧化硫生成亚硫酸盐,再用浓硫酸处理;
(5)根据等质量的硫黄和FeS2可以先计算出硫磺和FeS2中的S原子的物质的量之比,再遵守S原子守恒即可计算出硫酸的质量比.
解答 解:工业上生产硫酸主要分为造气、催化氧化、吸收三个阶段,造气主要用硫铁矿(FeS2)与氧气在高温条件下反应生成二氧化硫气体,生成的二氧化硫气体再与经过净化、干燥除去有害成分的空气一起通到催化反应室进行催化氧化生成三氧化硫,最后再用98%的硫酸溶液吸收三氧化硫制得发烟硫酸,再加水稀释得到浓硫酸;
(1)根据以上分析,二氧化硫催化氧化生成三氧化硫需要催化剂,而催化剂又要注意不能中毒失效,所以操作I的内容是净化、干燥除去有害成分,操作目的是防止催化剂中毒;吸收塔用98%的硫酸溶液吸收三氧化硫制得发烟硫酸再加水稀释得到浓硫酸,所以物质B是H2O,a=98,故答案为:干燥除去有害成分;防止催化剂中毒;H2O;98;
(2)造气主要用硫铁矿(FeS2)与氧气在高温条件下反应生成二氧化硫气体和红棕色固体三氧化二铁,方程式为:4FeS2+1102$\frac{\underline{\;高温\;}}{\;}$8SO2+2Fe203,故答案为:4FeS2+1102$\frac{\underline{\;高温\;}}{\;}$8SO2+2Fe203;
(3)因为常压下SO2转化为SO3的转化率已很大,所以增大压强虽然能增大SO2转化为SO3的转化率,但是增大压强,成本也随之增大,则实际生产在常压下即可,故答案为:常压下SO2转化为SO3的转化率已很大;
(4)工业生产中常用氨-酸法进行尾气脱硫,即先用氨水吸收,再用浓硫酸处理,氨水吸收时,发生反应:SO2+2NH3•H2O═(NH4)2SO3,再用浓硫酸处理时,发生反应:(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O,以达到消除污染、废物利用的目的;
故答案为:SO2+2NH3•H2O═(NH4)2SO3,(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O;
(5)已知n=$\frac{mg}{Mg/mol}$,可知等质量的硫磺和FeS2的物质的量之比与二者摩尔质量之比成反比,则硫磺和FeS2的物质的量之比为 $\frac{120g/mol}{32g/mol}$=$\frac{15}{4}$,所以其S原子的物质的量之比15:4×2=15:8,在制备硫酸的过程中遵守硫原子守恒,且原料的总利用率均为90%,所以生成硫酸的质量比等于物质的量之比即硫原子的物质的量之比为=15:8;故答案为:15:8.
点评 本题考查的知识点多,主要是工业接触法制硫酸的流程、原理、工业尾气的处理、化学方程式书写以及守恒法计算等,只有掌握相关的基础知识,解题并不困难,题目难度中等.

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案| A. | 细菌冶金能充分利用资源和废物,能耗低 | |
| B. | 细菌冶金不产生二氧化硫等有毒气体,环境污染少 | |
| C. | 细菌冶金温度越高,化学反应速率越快,采矿效率越高 | |
| D. | 推广细菌冶金体现了绿色化学理念,有利于经济可持续发展 |
| A. | CH≡C-CH2CH3 | B. | CH3C≡CH | C. | CH3CH2CH═CH2 | D. | CH2═CH-CH═CH2 |
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/mol/L | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/mol/L | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
(2)20min时改变的条件是向容器中加入0.8molNO2;重新达到平衡时,NO2的体积分数B(填字母)
A.增大B.减小C.不变D.无法判断
(3)用电离方程式表示N2H4•H2O显碱性的原因N2H4•H2O?N2H5++OH-(或N2H4+H2O?N2H5++OH-).
(4)相同条件下,1mol N2H4最多能与2mol HCl发生反应.
(5)常温下,若将0.2mol/LN2H4•H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H${\;}_{5}^{+}$、Cl-、OH-、H+四种离子浓度由大到小的顺序为c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
(提示:相同条件下,N2H4•H2O的电离程度大于N2H5Cl的水解程度.)

 .
.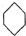 (g)?3H2(g)+
(g)?3H2(g)+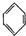 (g)△H1
(g)△H1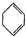 (g)△H2=+28.6KJ/mol
(g)△H2=+28.6KJ/mol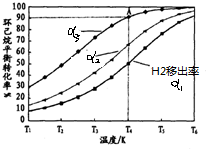
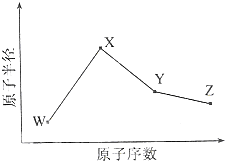 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.