题目内容
18.下列化学用语表示正确的是( )| A. | 甲烷的结构式:CH4 | |
| B. | 硫离子的结构示意图: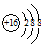 | |
| C. | Na2S的电子式: | |
| D. | 硫酸钠电离方程式:Na2SO4=Na2++SO42- |
分析 A.结构式应将所成的化学键用短线表示出来;
B.硫离子核内有16个质子,核外有3个电子层,从内到外依次容纳2,8,8个电子;
C.硫化钠为离子化合物,硫离子与2个钠离子通过离子键结合;
D.电荷不守恒.
解答 解:A.甲烷的结构式为 ,故A错误;
,故A错误;
B.硫离子核内有16个质子,核外有3个电子层,从内到外依次容纳2,8,8个电子,硫离子的结构示意图: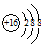 ,故B正确;
,故B正确;
C.Na2S为离子化合物,钠离子用离子符号表示,硫离子标出最外层电子,硫化钠的电子式为: ,故C错误;
,故C错误;
D.硫酸钠为强电解质,完全电离,电离方程式:Na2SO4=2Na++SO42-,故D错误;
故选:B.
点评 本题考查了电子式、原子结构示意图、电离方程式、有机物结构式的书写,熟悉相关化学用语的使用方法是解题关键,有利于学生养成正确使用化学用语的习惯.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
9.向10mL浓度均为3mol•L-1的HNO3与H2SO4的混合溶液中加入1.92g铜,充分反应后,设溶液体积仍为10mL,则产生的气体在标准状况下的体积是多少升( )
| A. | 0.448 L | B. | 0.224L | C. | 0.336L | D. | 无法求解 |
6.下列关于钠的化合物的说法中,正确的是( )
| A. | Na2CO3和NaHCO3均能与盐酸和NaOH溶液反应 | |
| B. | Na2CO3固体中含有的NaHCO3可用加热的方法除去 | |
| C. | Na2O2和Na2O均为白色固体,与CO2反应均放出O2 | |
| D. | 分别向Na2CO3和NaHCO3与澄清石灰水反应,现象不相同 |
13.下列离子方程式中,正确的是( )
| A. | NH4HSO3溶于过量NaOH溶液中:HSO3-+OH-═SO32-+H2O | |
| B. | 酸性KMnO4溶液与FeSO4溶液反应:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O | |
| C. | CaCO3溶于CH3COOH溶液中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 标准状况下足量Cl2通入100mL0.1 mol•L-1FeBr2溶液中:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
10.下列事实不属于盐类水解应用的是( )
| A. | 将氯化铝溶液加热蒸干灼烧可得到氧化铝 | |
| B. | 实验室通常使用热的纯碱溶液去除油污 | |
| C. | 铵态氮肥不宜与草木灰混合使用 | |
| D. | 用大理石与醋酸制取少量二氧化碳 |
7.亚硫酸钠(Na2SO3)在反应中既可作氧化剂,又可作还原剂.当它作氧化剂时,理论上可能被还原成的是( )
①H2SO4 ②S ③Na2S ④Na2SO4 ⑤H2SO3 ⑥Na2S2O3.
①H2SO4 ②S ③Na2S ④Na2SO4 ⑤H2SO3 ⑥Na2S2O3.
| A. | ①④ | B. | ①②③ | C. | ①⑤⑥ | D. | ②③⑥ |
8.下列叙述正确的是( )
| A. | NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心 | |
| B. | CH2Cl2是非极性分子,分子中C原子处在H、Cl原子所组成的四边形的中心 | |
| C. | H2O是极性分子.分子中O原子不处在2个H原子所连成的直线的中央 | |
| D. | CO2中的C=O键是极性键,所以CO2是极性分子 |
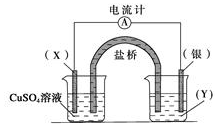 依据反应:2Ag+(aq)+Cu(s)=Cu2+ (aq)+2Ag(s)设计的原电池如图所示.
依据反应:2Ag+(aq)+Cu(s)=Cu2+ (aq)+2Ag(s)设计的原电池如图所示.