题目内容
3.现有以下物质:①Al ②稀硫酸 ③NaHCO3 ④NH3 ⑤盐酸 ⑥蔗糖溶液 ⑦无水乙醇 ⑧熔融NaOH ⑨NaHSO4 ⑩CO2,回答下列问题(用相应物质的序号填写)(1)可以导电的有①②⑤⑧
(2)属于非电解质的有④⑦⑩
(3)请写出⑨在水溶液中的电离方程式NaHSO4=Na++H++SO42-
(4)写出③中的物质的溶液与⑤的溶液反应的化学方程式NaHCO3+HCl═NaCl+H2O+CO2↑
(5)写出①与⑧物质的溶液反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.
分析 (1)电解质是在熔融状态或水溶液中能导电的化合物,电解质在熔融状态下或水溶液中能导电,金属单质和半导体材料能导电;
(2)非电解质是在熔融状态和水溶液中都不导电的化合物;
(3)NaHSO4是盐,在水溶液中完全电离;
(4)NaHCO3与盐酸反应生成氯化钠、水和二氧化碳;
(5)Al与氢氧化钠溶液反应生成偏铝酸钠和氢气.
解答 解:(1)物质能导电必须存在能自由移动的带电微粒.电解质在熔融状态下或水溶液中能导电,金属单质和石墨等存在自由电子能导电,①②⑤⑧能导电,
故答案为:①②⑤⑧;
(2)非电解质是在熔融状态和水溶液中都不导电的化合物,④液氨属于非电解质; ⑥蔗糖溶液是混合物不是非电解质 ⑦无水乙醇是非电解质 ⑩CO2是非电解质,故答案为:④⑦⑩;
(3)NaHSO4是盐,在水溶液中完全电离出Na+、H+和SO42-,电离方程式为:NaHSO4=Na++H++SO42-,故答案为:NaHSO4=Na++H++SO42-;
(4)NaHCO3与盐酸反应生成氯化钠、水和二氧化碳,其反应的化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑,故答案为:NaHCO3+HCl═NaCl+H2O+CO2↑;
(5)Al与氢氧化钠溶液反应生成偏铝酸钠和氢气,其反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑.
点评 本题考查电解质和非电解质的判断、离子方程式和电离方程式的书写等知识,题目难度不大,注意能导电的物质的类别.

练习册系列答案
相关题目
14.下列液体均处于25℃,有关叙述正确的是( )
| A. | 某物质的溶液pH<7,则该物质一定是酸 | |
| B. | 等物质的量浓度的Na2CO3溶液的碱性强于NaHCO3溶液 | |
| C. | pH=4的番茄汁中c(H+)是pH=6的牛奶中c(H+)的2倍 | |
| D. | AgCl在相同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同 |
11.化学与生活密切相关,生活中的某些问题,常需用化学知识解释,下列说法不正确的是( )
| A. | 医疗中用75%的乙醇溶液进行消毒,是由于蛋白质遇酒精会变性 | |
| B. | 臭氧可用于自来水消毒,是因为臭氧具有强氧化性能杀死水中的病菌 | |
| C. | 腌制熟食品时,添加少量NaNO2,是为了使其味道更加美味可口 | |
| D. | 食盐中加入少量碘酸钾,食用后可补充人体内碘元素的不足 |
18.下列化学用语表示正确的是( )
| A. | 甲烷的结构式:CH4 | |
| B. | 硫离子的结构示意图: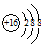 | |
| C. | Na2S的电子式: | |
| D. | 硫酸钠电离方程式:Na2SO4=Na2++SO42- |
13.一定温度下在一容积不变的密闭容器中发生可逆反应2X(g)?Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
| A. | 混合气体的密度不再变化 | B. | 反应容器中Y的质量分数不变 | ||
| C. | 体系压强不再变化 | D. | Z的浓度不再变化 |

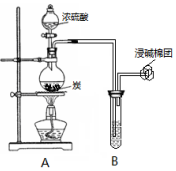 某小组同学利用如图装置开展实验,请回答:
某小组同学利用如图装置开展实验,请回答: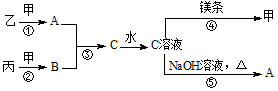 甲、乙、丙均为中学化学常见的气体单质,A为10电子化合物,B为18电子化合物,各物质之间存在如图所示的转化关系(部分反应条件及产物略去):
甲、乙、丙均为中学化学常见的气体单质,A为10电子化合物,B为18电子化合物,各物质之间存在如图所示的转化关系(部分反应条件及产物略去): .
.