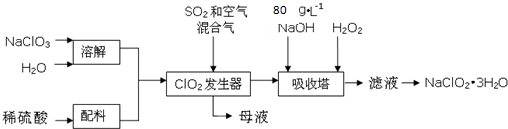
题目内容
【化学选修2:化学与技术】
(1)火山喷发所产生的硫磺可用于生产重要的化工原料硫酸.某企业用右图所示的工艺流程生产硫酸:
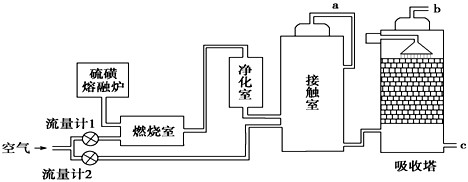
请回答下列问题:
①为充分利用反应放出的热量,接触室中应安装 (填设备名称).吸收塔中填充有许多瓷管,其作用是 .
②为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%.为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为 .假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 .(空气中氧气的体积分数按0.2计),该尾气的处理方法是 .
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是 (可多选).
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废气减少 D.不需要使用催化剂
(2)硫酸的用途非常广泛,可应用于下列哪些方面 (可多选).
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一.在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式 .
(1)火山喷发所产生的硫磺可用于生产重要的化工原料硫酸.某企业用右图所示的工艺流程生产硫酸:

请回答下列问题:
①为充分利用反应放出的热量,接触室中应安装
②为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%.为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废气减少 D.不需要使用催化剂
(2)硫酸的用途非常广泛,可应用于下列哪些方面
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一.在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式
考点:工业制取硫酸
专题:氧族元素
分析:(1)①SO2与O2的反应为放热反应,为了充分利用能量,应安装热交换器;吸收塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收.
②根据反应过程分布计算;
③A、硫铁矿中铁的氧化需要消耗O2;
B、原料选择与SO2的转化率无关;
C、用硫铁矿为原料产生的废渣较多,但废气量相同;
D、用SO2制取SO3的过程中都需要使用催化剂;
(2)A、橡胶硫化所用到的为单质硫;
B、烷基苯磺酸钠中含有磺酸基,制取过程中需要发生磺化反应;
C、铅蓄电池中需要用到硫酸和硫酸铅;
D、过磷酸钙的制取过程中需要浓硫酸和磷矿石;
(3)CaCO3高温分解生成CO2和CaO,SO2为酸性氧化物,可以和碱性氧化物CaO反应生成CaSO3,而CaSO3易被氧化为CaSO4.
②根据反应过程分布计算;
③A、硫铁矿中铁的氧化需要消耗O2;
B、原料选择与SO2的转化率无关;
C、用硫铁矿为原料产生的废渣较多,但废气量相同;
D、用SO2制取SO3的过程中都需要使用催化剂;
(2)A、橡胶硫化所用到的为单质硫;
B、烷基苯磺酸钠中含有磺酸基,制取过程中需要发生磺化反应;
C、铅蓄电池中需要用到硫酸和硫酸铅;
D、过磷酸钙的制取过程中需要浓硫酸和磷矿石;
(3)CaCO3高温分解生成CO2和CaO,SO2为酸性氧化物,可以和碱性氧化物CaO反应生成CaSO3,而CaSO3易被氧化为CaSO4.
解答:
解:(1)①SO2与O2的反应为放热反应,为了充分利用能量,应安装热交换器;吸收塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收,故答案为:热交换器;使浓H2SO4与SO3充分接触;
②燃烧室中的反应为S+O2
SO2,假设SO2的体积为x,则流量计1中通入氧气的体积为1.5x,接触室中的反应为2SO2+O2
2SO3,则流量计2中通入氧气的体积为1.25x;流量计1中通入空气的体积为7.5x,流量计2中通入空气的体积为6.25x,故流经流量计1和流量计2的空气体积比应为7.5x:6.25x=6:5;燃烧室剩余空气6.5x,接触室剩余空气6.25x-x=5.775x,剩余SO2为0.05x,故b管尾气中SO2的体积分数为0.41%;SO2为酸性氧化物,可以用碱液(如氨水)吸收,
故答案为:6:5;0.41%; 用氨水吸收;
③硫铁矿中铁的氧化需要消耗O2,A项正确;原料选择与SO2的转化率无关,B项错误;用硫铁矿为原料产生的废渣较多,但废气量相同,C项错误;用SO2制取SO3的过程中都需要使用催化剂,D项错误,故选:A;
(2)橡胶硫化所用到的为单质硫,A项错误;烷基苯磺酸钠中含有磺酸基,制取过程中需要发生磺化反应,B项正确;铅蓄电池中需要用到硫酸和硫酸铅,C项正确;过磷酸钙的制取过程中需要浓硫酸和磷矿石,D项正确,故选:BCD;
(3)CaCO3高温分解生成CO2和CaO,SO2为酸性氧化物,可以和碱性氧化物CaO反应生成CaSO3,而CaSO3易被氧化为CaSO4,所以发生反应的化学方程式为:CaCO3═CaO+CO2↑ SO2+CaO═CaSO3 2CaSO3+O2═2CaSO4,故答案为:CaCO3═CaO+CO2↑、SO2+CaO═CaSO3、2CaSO3+O2═2CaSO4.
②燃烧室中的反应为S+O2
| ||
| ||
| △ |
故答案为:6:5;0.41%; 用氨水吸收;
③硫铁矿中铁的氧化需要消耗O2,A项正确;原料选择与SO2的转化率无关,B项错误;用硫铁矿为原料产生的废渣较多,但废气量相同,C项错误;用SO2制取SO3的过程中都需要使用催化剂,D项错误,故选:A;
(2)橡胶硫化所用到的为单质硫,A项错误;烷基苯磺酸钠中含有磺酸基,制取过程中需要发生磺化反应,B项正确;铅蓄电池中需要用到硫酸和硫酸铅,C项正确;过磷酸钙的制取过程中需要浓硫酸和磷矿石,D项正确,故选:BCD;
(3)CaCO3高温分解生成CO2和CaO,SO2为酸性氧化物,可以和碱性氧化物CaO反应生成CaSO3,而CaSO3易被氧化为CaSO4,所以发生反应的化学方程式为:CaCO3═CaO+CO2↑ SO2+CaO═CaSO3 2CaSO3+O2═2CaSO4,故答案为:CaCO3═CaO+CO2↑、SO2+CaO═CaSO3、2CaSO3+O2═2CaSO4.
点评:本题是对化学与技术及工业生产的考查,需要学生细读生产工艺图中各物质的变化进行解答,把握氨碱法、制备浓硫酸的工艺流程及设备的作用、发生的化学反应为解答的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
重水(2H2O)是重要的核工业原料,下列说法不正确的是( )
A、氘(
| ||||
B、
| ||||
| C、1H2O与2H2O是同一种物质 | ||||
| D、1H218O与2H216O的相对分子质量相同 |
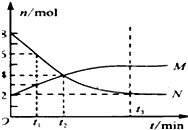 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A、反应的化学方程式为:N?2M |
| B、t2时,正逆反应速率相等,达到平衡 |
| C、平衡时,N的转化率是75% |
| D、t1分钟内,反应速率:v(M)=2v(N) |
关于苹果酸(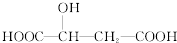 )说法正确的是( )
)说法正确的是( )
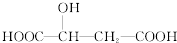 )说法正确的是( )
)说法正确的是( )| A、苹果酸不易溶于水而易溶于有机溶剂 |
| B、和苹果酸具有相同官能团的同分异构体只有1种 |
| C、1 mol苹果酸与足量NaOH溶液反应时,最多消耗3 mol NaOH |
| D、1mol苹果酸与足量NaHCO3溶液反应时,最多可得44.8LCO2(标准状况下) |
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是( )
| A、与NaOH反应的氯气一定为0.3 mol |
| B、若反应中转移的电子为n mol,则0.15<n<0.25 |
| C、n(Na+):n(Cl-)可能为7:3 |
| D、n(NaCl):n(NaClO):n(NaClO3)可能为8:2:1 |
共价键、金属键、离子键和分子间作用力都是构成物质微粒间的不同相互作用,含有上述中两种相互作用的晶体是( )
| A、SiO2晶体 |
| B、Ar晶体 |
| C、NaCl晶体 |
| D、NaOH晶体 |
设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A、标准状况下,2.24LCH4所含质子数为0.1NA |
| B、0.1mol Fe与足量氯气反应转移的电子数为0.2NA |
| C、0.1mol C8H18分子中共价键总数为2.5NA |
| D、100mL 1mol/L醋酸溶液中离子总数为0.2NA |