题目内容
共价键、金属键、离子键和分子间作用力都是构成物质微粒间的不同相互作用,含有上述中两种相互作用的晶体是( )
| A、SiO2晶体 |
| B、Ar晶体 |
| C、NaCl晶体 |
| D、NaOH晶体 |
考点:不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:一般金属元素与非金属元素形成离子键,非金属元素之间形成共价键,离子晶体中含有离子键,以共价键结合的物质可能为原子晶体,也可能为分子晶体,在分子晶体中还存在分子间作用力,以此来解答.
解答:
解:A、SiO2晶体属于原子晶体,晶体中存在共价键,故A不选;
B、Ar晶体属于分子晶体,分子间通过分子间作用力结合,故B不选;
C、氯化钠属于离子晶体,微粒间以离子键结合,故C不选;
D、氢氧化钠属于离子晶体,阴阳离子间通过离子键结合,氢氧根离子中O元素与H元素间形成共价键,所以氢氧化钠中含有两种作用力,故D选.
故选D.
B、Ar晶体属于分子晶体,分子间通过分子间作用力结合,故B不选;
C、氯化钠属于离子晶体,微粒间以离子键结合,故C不选;
D、氢氧化钠属于离子晶体,阴阳离子间通过离子键结合,氢氧根离子中O元素与H元素间形成共价键,所以氢氧化钠中含有两种作用力,故D选.
故选D.
点评:本题考查了不同晶体中微粒间的作用力,题目难度不大,注意把握不同类型晶体的构成微粒和微粒间的作用力.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
下列反应属于吸热反应的是( )
| A、氢气在空气中燃烧 |
| B、盐酸与氢氧化钠中和反应 |
| C、Ba(OH)2?8H2O与NH4Cl固体混合反应 |
| D、金属Zn与盐酸反应 |
某原子的最外电子层上只有1个电子,则它跟氯结合能形成的化学键( )
| A、一定是共价键 |
| B、一定是离子键 |
| C、可能是共价键,也可能是离子键 |
| D、以上说法均不正确 |
已知:断裂下列化学键需要吸收的能量分别为:H-H 436kJ/mol;F-F 153kJ/mol;H-F 565kJ/mol.下列说法正确的是( )
| A、H2与F2反应的热化学方程式为:H2(g)+F2(g)=2HF(g);△H=-541 kJ |
| B、2 L HF气体分解成1 L H2和1 L F2吸收541 kJ的热量 |
| C、在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 |
| D、1 mol H2与1 mol F2反应生成2 mol液态HF放出热量小于541 kJ |
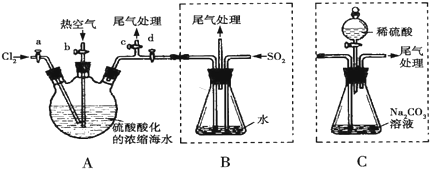
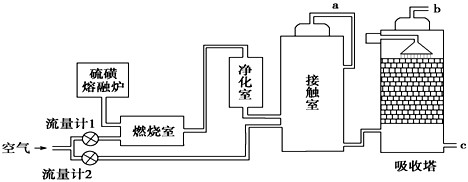
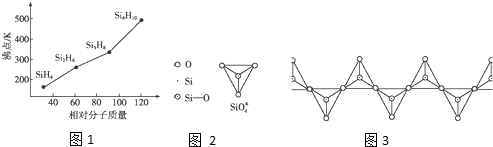
 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是:( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是:( )