题目内容
设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A、标准状况下,2.24LCH4所含质子数为0.1NA |
| B、0.1mol Fe与足量氯气反应转移的电子数为0.2NA |
| C、0.1mol C8H18分子中共价键总数为2.5NA |
| D、100mL 1mol/L醋酸溶液中离子总数为0.2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据n=
计算物质的量,结合分子式计算质子数;
B、铁和氯气反应生成氯化铁;
C、C8H18分子属于烷烃,结合烷烃分子结构计算所含共价键;
D、醋酸是弱电解质存在电离平衡.
| V |
| Vm |
B、铁和氯气反应生成氯化铁;
C、C8H18分子属于烷烃,结合烷烃分子结构计算所含共价键;
D、醋酸是弱电解质存在电离平衡.
解答:
解:A、依据n=
计算物质的量=
=0.1mol,结合甲烷分子是10电子分子计算,0.1mol甲烷含质子数为NA,故A错误;
B、铁和氯气反应生成氯化铁,0.1mol Fe与足量氯气反应转移的电子数为0.3NA,故B错误;
C、C8H18分子属于烷烃,结合烷烃分子结构计算所含共价键=0.1mol(18+8-1);×NA=2.5NA,故C正确;
D、醋酸是弱电解质存在电离平衡,100mL 1mol/L醋酸溶液中离子总数小于0.2NA,故D错误;
故选C.
| V |
| Vm |
| 2.24L |
| 22.4L/mol |
B、铁和氯气反应生成氯化铁,0.1mol Fe与足量氯气反应转移的电子数为0.3NA,故B错误;
C、C8H18分子属于烷烃,结合烷烃分子结构计算所含共价键=0.1mol(18+8-1);×NA=2.5NA,故C正确;
D、醋酸是弱电解质存在电离平衡,100mL 1mol/L醋酸溶液中离子总数小于0.2NA,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的分析判断,主要是气体摩尔体积计算,分子结构的理解应用,弱电解质电离平衡的判断,掌握基础是关键,题目较简单.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
下列物质中除水分子外,无其他分子存在的是( )
| A、氨水 | B、氯水 |
| C、浓硫酸 | D、食盐水 |
某原子的最外电子层上只有1个电子,则它跟氯结合能形成的化学键( )
| A、一定是共价键 |
| B、一定是离子键 |
| C、可能是共价键,也可能是离子键 |
| D、以上说法均不正确 |
已知:断裂下列化学键需要吸收的能量分别为:H-H 436kJ/mol;F-F 153kJ/mol;H-F 565kJ/mol.下列说法正确的是( )
| A、H2与F2反应的热化学方程式为:H2(g)+F2(g)=2HF(g);△H=-541 kJ |
| B、2 L HF气体分解成1 L H2和1 L F2吸收541 kJ的热量 |
| C、在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 |
| D、1 mol H2与1 mol F2反应生成2 mol液态HF放出热量小于541 kJ |
某氢氧化钾样品中含K2CO3 5.0%、H2O 4.2%、KHCO3 1.5%,取a g样品溶于40mL 2mol/L的盐酸后,并用0.5mol/L的KOH溶液中和剩余的酸,最后蒸发所得溶液,得干燥的固体质量为( )
| A、5.96g |
| B、4.68g |
| C、2.15g |
| D、3.78g |
下列热化学方程式或离子方程式不正确的是( )
| A、向1mol?L-1明矾溶液50mL中滴入数滴0.1mol?L-1Ba(OH)2溶液Al3++2 SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ |
| B、将1mol?L-1 NaAlO2溶液和1.5mol?L-1的HCl溶液等体积互相均匀混合6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ |
| C、甲烷的标准燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 |
| D、将少量CO2气体通入NaClO溶液中:CO2+H2O+2ClO-=CO32-+2HClO |
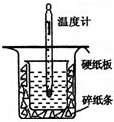 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题