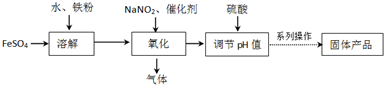
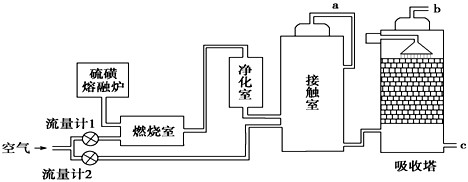
题目内容
重水(2H2O)是重要的核工业原料,下列说法不正确的是( )
A、氘(
| ||||
B、
| ||||
| C、1H2O与2H2O是同一种物质 | ||||
| D、1H218O与2H216O的相对分子质量相同 |
考点:质子数、中子数、核外电子数及其相互联系,核素,相对分子质量及其计算
专题:
分析:A.根据核组成符合判断;
B.具有一定数目质子和一定数目中子的一种原子称为核素;
C.两种分子中所含原子不同;
D.1H218O的相对分子质量为:1×2+18=20,D216O的相对分子质量为:2×2+16=20.
B.具有一定数目质子和一定数目中子的一种原子称为核素;
C.两种分子中所含原子不同;
D.1H218O的相对分子质量为:1×2+18=20,D216O的相对分子质量为:2×2+16=20.
解答:
解:A.核组成符合左下方数字为质子数,故氘质子数为1,故A正确;
B.具有一定数目质子和一定数目中子的一种原子称为核素,
H与
H质子数相同,中子数不同,是氢元素的不同的核素,故B正确;
C.两种分子中氢元素所含核素不同,前者为普通水,后者为中水,不是同种物质,故C错误;
D.1H218O的相对分子质量为:1×2+18=20,D216O的相对分子质量为:2×2+16=20,故D正确,
故选C.
B.具有一定数目质子和一定数目中子的一种原子称为核素,
1 1 |
2 1 |
C.两种分子中氢元素所含核素不同,前者为普通水,后者为中水,不是同种物质,故C错误;
D.1H218O的相对分子质量为:1×2+18=20,D216O的相对分子质量为:2×2+16=20,故D正确,
故选C.
点评:本题考查核素、同位素及质子数质子数和质量数关系,把握相关的概念及核变化为解答的关键,选项D为解答的易错点,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
Al2O3是刚玉的主要成分.Al2O3属于( )
| A、酸 | B、盐 | C、氧化物 | D、单质 |
下列溶液中,一定能大量共存的离子组是( )
| A、无色溶液中:Na+、MnO4-、SO42-、K+ |
| B、使蓝色石蕊试纸变红的溶液中:K+、S2-、NO3-、OH- |
| C、加入Al能放出H2的溶液中:K+、NH4+、NO3-、Cl- |
| D、含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42- |
常温下,以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等,通过添加过量的难溶电解质MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是( )
| A、过滤后的溶液中一定没有S2- |
| B、MnS难溶于水,可溶于MnCl2溶液中 |
| C、常温时,CuS、PbS、CdS比MnS更难溶 |
| D、加入MnS后生成CuS的离子方程式是Cu2++S2-=CuS↓ |
下列物质中除水分子外,无其他分子存在的是( )
| A、氨水 | B、氯水 |
| C、浓硫酸 | D、食盐水 |