题目内容
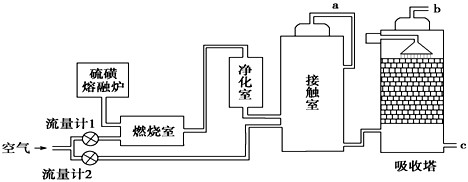
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2?3H2O.
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.
③80g?L-1 NaOH溶液是指80g NaOH固体溶于水所得溶液的体积为1L.
(1)80g?L-1 NaOH溶液的物质的量浓度为
(2)发生器中鼓入空气的作用可能是 (选填序号)
a.将SO2氧化成SO3,增强酸性 b.将NaClO3氧化成ClO2 c.稀释ClO2以防止爆炸
(3)从“母液”中可回收的主要物质是
(4)吸收塔内的反应的化学方程式为
吸收塔的温度不能超过20℃,其目的是
(5)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 .
(6)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中.除H2O2外,还可以选择的还原剂是 (选填序号)
a.Na2S b.Na2O2 c.FeCl2
(7)从吸收塔出来的溶液中得到NaClO2?3H2O粗晶体的实验操作依次是 (选填序号).
a.蒸发浓缩 b.蒸馏 c.过滤 d.灼烧e.冷却结晶.

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2?3H2O.
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.
③80g?L-1 NaOH溶液是指80g NaOH固体溶于水所得溶液的体积为1L.
(1)80g?L-1 NaOH溶液的物质的量浓度为
(2)发生器中鼓入空气的作用可能是
a.将SO2氧化成SO3,增强酸性 b.将NaClO3氧化成ClO2 c.稀释ClO2以防止爆炸
(3)从“母液”中可回收的主要物质是
(4)吸收塔内的反应的化学方程式为
吸收塔的温度不能超过20℃,其目的是
(5)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是
(6)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中.除H2O2外,还可以选择的还原剂是
a.Na2S b.Na2O2 c.FeCl2
(7)从吸收塔出来的溶液中得到NaClO2?3H2O粗晶体的实验操作依次是
a.蒸发浓缩 b.蒸馏 c.过滤 d.灼烧e.冷却结晶.
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)浓度g/L表示1L溶液中所含溶质质量的多少.80g/LNaOH溶液表示1L氢氧化钠溶液含有80gNaOH.令溶液体积为1L,计算氢氧化钠的物质的量.利用c=
计算氢氧化钠溶液的物质的量浓度.
(2)由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.据此解答.
(3)根据题目信息并运用氧化还原反应理论判断反应物、生成物.
(4)根据流程信息可知,吸收塔内生成ClO2,一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生.据此书写方程式.
温度过高,H2O2容易分解.
(5)NaOH过量则溶液呈碱性,但考虑到该溶液有强氧化性,选择指示剂或pH试纸检验会遇到氧化褪色问题,故工业生产中主要是用pH计连续测定溶液pH.
(6)还原性要适中.还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产.Na2O2溶于水相当于H2O2.
(7)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.
| n |
| V |
(2)由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.据此解答.
(3)根据题目信息并运用氧化还原反应理论判断反应物、生成物.
(4)根据流程信息可知,吸收塔内生成ClO2,一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生.据此书写方程式.
温度过高,H2O2容易分解.
(5)NaOH过量则溶液呈碱性,但考虑到该溶液有强氧化性,选择指示剂或pH试纸检验会遇到氧化褪色问题,故工业生产中主要是用pH计连续测定溶液pH.
(6)还原性要适中.还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产.Na2O2溶于水相当于H2O2.
(7)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.
解答:
解:(1)浓度g/L表示1L溶液中所含溶质质量的多少.80g/LNaOH溶液表示1L氢氧化钠溶液含有80gNaOH.令溶液体积为1L,则80gNaOH的物质的量为
=2mol.所以该溶液氢氧化钠的物质的量浓度c(NaOH)=
=2mol/L.
故答案为:2mol/L.
(2)由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.发生器中鼓入空气的作用应是稀释ClO2以防止爆炸.
故选:c.
(3)根据流程信息可知,发生器内生成ClO2,所以一定有NaClO3→ClO2化合价降低,被还原;
则二氧化硫被氧化成硫酸钠,反应的方程式为:2NaClO3+SO2=2ClO2↑+Na2SO4,ClO2进入吸收塔,则硫酸钠留在母液中,故从母液中可回收硫酸钠;
故答案为:Na2SO4;
(4)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,
反应方程式为2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2.
H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能超过20℃,其目的是防止H2O2分解.
故答案为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;防止H2O2分解.
(5)NaOH过量则溶液呈碱性,但考虑到该溶液有强氧化性,选择指示剂或pH试纸检验会遇到氧化褪色问题,故生产中主要是用pH计连续测定溶液pH.
故答案为:连续测定吸收塔内溶液的pH.
(6)还原性要适中.还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产.Na2O2溶于水相当于H2O2.
Na2S、FeCl2还原性较强,生成物与NaClO2分离比较困难.
故选:b.
(7)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.所以操作顺序为a、e、c.
故答案为:a、e、c.
| 80g |
| 40g/mol |
| 2mol |
| 1L |
故答案为:2mol/L.
(2)由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.发生器中鼓入空气的作用应是稀释ClO2以防止爆炸.
故选:c.
(3)根据流程信息可知,发生器内生成ClO2,所以一定有NaClO3→ClO2化合价降低,被还原;
则二氧化硫被氧化成硫酸钠,反应的方程式为:2NaClO3+SO2=2ClO2↑+Na2SO4,ClO2进入吸收塔,则硫酸钠留在母液中,故从母液中可回收硫酸钠;
故答案为:Na2SO4;
(4)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,
反应方程式为2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2.
H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能超过20℃,其目的是防止H2O2分解.
故答案为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;防止H2O2分解.
(5)NaOH过量则溶液呈碱性,但考虑到该溶液有强氧化性,选择指示剂或pH试纸检验会遇到氧化褪色问题,故生产中主要是用pH计连续测定溶液pH.
故答案为:连续测定吸收塔内溶液的pH.
(6)还原性要适中.还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产.Na2O2溶于水相当于H2O2.
Na2S、FeCl2还原性较强,生成物与NaClO2分离比较困难.
故选:b.
(7)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.所以操作顺序为a、e、c.
故答案为:a、e、c.
点评:本题以学生比较陌生的亚氯酸钠制备为背景,以过氧化氢法制备亚氯酸钠为主线,考察学生阅读题目获取信息的能力、对浓度概念的理解、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力考察以及在新情境下综合运用知识解决问题的能力.题目有一定的难度.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
某氢氧化钾样品中含K2CO3 5.0%、H2O 4.2%、KHCO3 1.5%,取a g样品溶于40mL 2mol/L的盐酸后,并用0.5mol/L的KOH溶液中和剩余的酸,最后蒸发所得溶液,得干燥的固体质量为( )
| A、5.96g |
| B、4.68g |
| C、2.15g |
| D、3.78g |
今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Mg2+、Ba2+、CO32-、SO42-、Cl-,现取三份100mL溶液进行如下实验:根据上述实验,以下推测正确的是( )
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量KOH溶液加热后,收集到气体0.08mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量KOH溶液加热后,收集到气体0.08mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.
| A、Na+一定存在 |
| B、100mL溶液中含0.01mol CO32- |
| C、Cl-一定存在 |
| D、Ba2+一定不存在,Mg2+可能存在 |
 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是:( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是:( )| 选项 | A | B | C | D |
| X | C | Fe | Ca(OH)2溶液 | AlCl3 |
| W | O2 | HNO3 | CO2 | NH3?H2O |
| A、A | B、B | C、C | D、D |
下列热化学方程式或离子方程式不正确的是( )
| A、向1mol?L-1明矾溶液50mL中滴入数滴0.1mol?L-1Ba(OH)2溶液Al3++2 SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ |
| B、将1mol?L-1 NaAlO2溶液和1.5mol?L-1的HCl溶液等体积互相均匀混合6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ |
| C、甲烷的标准燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 |
| D、将少量CO2气体通入NaClO溶液中:CO2+H2O+2ClO-=CO32-+2HClO |
下列叙述不正确的是( )
| A、虽然石墨有较好的导电性,但它不属于电解质 |
| B、CaCO3、BaSO4都难溶于水,但它们都是电解质 |
| C、实验测定液态HCl、固体KNO3均不能导电,所以HCl、KNO3均是非电解质 |
| D、酒精(纯净物)在水溶液和熔融状态下均不能导电,所以酒精属于非电解质 |