题目内容
2. 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.(1)工业上,可以分离合成气中的氢气,用于合成氨,常用醋酸二氨合亚铜 AC溶液(AC=CH3COO-)来吸收合成气中的一氧化碳,其反应原理为:[Cu(NH3)2]AC(aq)+CO(g)+N3(g)?[Cu(NH3)3]AC•CO(aq)△H<0
常压下,将吸收一氧化碳的溶液处理重新获得 AC溶液的措施是加热;
(2)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)?2CO(g)+2H2(g).在密闭容器中通入物质的量浓度均为0.1mol•L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图1所示,则压强P1小于P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)大于v(逆)(填“大于”、“小于”或“等于”). 求Y点对应温度下的该反应的平衡常数K=1.6.(计算结果保留两位有效数字)
(3)CO可以合成二甲醚,二甲醚可以作为燃料电池的原料,化学反应原理为:CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H<0
①在恒容密闭容器里按体积比为1:4充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是B、D;
A.逆反应速率先增大后减小
C.反应物的体积百分含量减小
B.正反应速率先增大后减小
D.化学平衡常数K值增大
②写出二甲醚碱性燃料电池的负极电极反应式CH3OCH3-12e-+16OH-═2CO32-+11H2O;
③二甲醚燃料电池工作时,若以1.12L•min-l(标况)的速率向该电池中通入二甲醚,用该电池电解50mL 2mol•L-1 CuSO4溶液,通电0.50min后,计算理论上可析出金属铜的质量为6.4g
(4)已知l g二甲醚气体完全燃烧生成稳定的氧化物放出的热量为31.63kJ,请写出表示二甲醚燃烧热的热化学方程式CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(l)△H=-1454.98 kJ/mol.
分析 (1)根据反应[Cu(NH3)2]AC(aq)+CO(g)+NH3(g)?[Cu(NH3)3]AC•CO(aq)△H<0为放热反应及温度对化学平衡的影响进行解答;
(2)反应CO2(g)+CH4(g)?2CO(g)+2H2(g)是个气体体积增大的反应,根据压强对化学平衡的影响作答,由图知道该温度下Y所处条件下平衡时甲烷的转化率列三段式,带入化学平衡常数计算可得;
(3)①根据影响化学平衡的因素进行判断;
②原电池负极发生氧化反应,二甲醚在碱性条件下失去电子生成碳酸根离子和水,据此写出电极反应;
③依据二甲醚通入的量计算物质的量,结合电子守恒计算析出铜的质量;
(4)已知l g二甲醚气体完全燃烧生成稳定的氧化物放出的热量,计算1mol二甲醚气体完全燃烧生成稳定的氧化物放出的热量可得燃烧热的热化学方程式.
解答 解:(1)[Cu(NH3)2]AC(aq)+CO(g)+NH3(g)?[Cu(NH3)3]AC•CO(aq)△H<0,该反应为放热反应,升高温度,平衡向着逆向移动,可以将吸收一氧化碳的溶液处理重新获得[Cu(NH3)2]AC;
故答案为:加热;
(2)反应CO2(g)+CH4(g)?2CO(g)+2H2(g)是个气体体积增大的反应,压强越大,CH4的转化率越小,由图可知相同温度下,P1条件下的转化率大于P2,则P1小于P2;压强为P2时,在Y点反应未达到平衡,则反应正向移动,所以v(正)>v(逆);
由图知道该温度下Y所处条件下平衡时甲烷的转化率为80%,列三段式:
CO2(g)+CH4(g)?2CO(g)+2H2(g)
c始:0.1 0.1 0 0
c转:0.08 0.08 0.16 0.16
c平:0.02 0.02 0.16 0.16,
其平衡常数K=$\frac{0.1{6}^{2}×0.1{6}^{2}}{0.02×0.02}$=1.6;
故答案为:小于;大于; 1.6;
(3)①A.逆反应速率先增大后减小,可以升高温度,正逆反应速率都增大,平衡向着逆向移动,满足了逆反应速率先增大后逐渐减小,故A错误;
B.正反应速率先增大后减小,说明是增大了压强或增加反应物浓度,无论改变说明条件,平衡一定向着正向移动,故B正确;
C.反应物的体积百分含量减小,如减少反应物浓度,平衡会向着逆向移动,故C错误;
D.化学平衡常数K值增大,说明生成物的浓度增大,反应物的浓度减小,平衡一定向着正向移动,故D正确;
故答案为:BD;
②二甲醚在碱性燃料电池的负极失去电子生成碳酸根离子和水,电极反应为CH3OCH3-12e-+16OH-═2CO32-+11H2O;
故答案为:CH3OCH3-12e-+16OH-═2CO32-+11H2O;
③以1.12L•min-l(标况)的速率向该电池中通入二甲醚,用该电池电解50mL 2mol•L-1 CuSO4溶液,通电0.50min后,通入二甲醚物质的量1.12L•min-l×0.5min×22.4L/mol═0.025mol;依据电极反应电子守恒,CH3OCH3--12e---6Cu2+,则n(Cu2+)=0.025mol×6=0.15mol,但溶液中的n(Cu2+)只有0.05mL×2mol•L-1=0.1mol,说明铜离子完全参与放电,溶液中水也参与放电,则铜离子全部析出,金属铜的质量为0.1mol×
64g/mol=6.4g;
故答案为:6.4g;
(4)l g二甲醚气体完全燃烧生成稳定的氧化物放出的热量为31.63kJ,则l mol二甲醚气体完全燃烧生成稳定的氧化物放出的热量为46g×31.63kJ=1454.98 kJ,则二甲醚燃烧热的热化学方程式为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(l)△H=-1454.98 kJ/mol;
故答案为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(l)△H=-1454.98 kJ/mol.
点评 本题考查了化学平衡的调控作用、化学平衡的影响因素、原电池工作原理及电极反应的书写、化学平衡常数的计算、化学平衡状态的判断等知识,题目难度较大,考查的知识点较大,充分考查了学生对化学平衡、原电池工作原理等知识的掌握情况,试题培养了学生的分析、理解能力及化学计算能力.

(1)在绝热固定容积的密闭容器发生反应:N2(g)+3H2(g)?2NH3(g),能说明上述反应向正反应方向移动的是②④
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N-H的同时生成2n mol H-H
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
④混合气体的平均摩尔质量增大
⑤容器内气体密度不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
①反应进行到2小时时放出的热量为27.78KJ
②0~l小时内N2的平均反应速率0.05mol•L-1•h-1;
③此条件下该反应的化学平衡常数K=0.15(保留两位小数)
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向正反应方向移动(填“正反应”、“逆反应”或“不移动”).
| A. | 在配制一定物质的量浓度溶液的实验中量筒是必需仪器 | |
| B. | 实验室中,盛装NaOH 溶液的试剂瓶用橡皮塞 | |
| C. | 某未知液中加入稀NaOH溶液,没有产生使湿润的红色石蕊试纸变蓝的气体,则该未知液中不含NH4+ | |
| D. | 用pH试纸测定某溶液的pH时,需预先用蒸馏水湿润pH 试纸 |
(1)恒容密闭窗口中,工业固氮反应N2(g)+3H2(g)?2NH3(g)的化学平衡常数K和温度的关系如表所示:
| 温度/℃ | 25 | 200 | 300 | 400 | 500 |
| K | 5×108 | 1.0 | 0.86 | 0.507 | 0.152 |
②有关工业合成氨的研究成果,曾于1918年、1931年、2007年三次荣膺诺贝尔化学奖.
下列关于合成氨反应描述的图象中,不正确的是C(填序号).
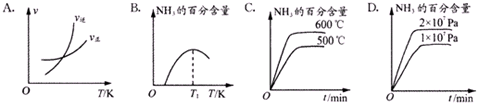
③400℃时,测得某时刻氨气、氮气、氢气物质的量浓度分别为3mol•L-1、2mol•L-1、1mol•L-1,则该反应的v正<v逆(填“>”、“<”或“=”)
(2)近年来,科学家又提出在常温、常压、催化剂等条件下合成氨的新思路,反应原理为:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),则其反应热△H=+1530kJ•mol-1.[已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)?2H2O(1)△H=-571.6kJ•mol-1]
(3)联氨(N2H4)、二氧化氮(NO2)可与KOH溶液构成碱性燃料电池,其电池反应原理为2N2H4+2NO2═3N2+4H2O,则负极的电极反应式为N2H4-4e-+4OH-=N2+4H2O.
(4)25℃时,将pH=3的盐酸和pH=11的氨水等体积混合后,溶液中的离子浓度由大到小的顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+).
(5)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液中c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+)(填表达式).(已知:H2SO3的Ka1=1.7×10-2mol•L-1,Ka2=6.0×10-8mol•L-1;NH3•H2O的Kb=1.8×10-5mol•L-1)
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图1所示:
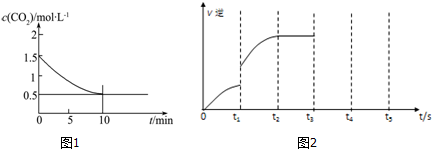
①该条件下反应的平衡常数为2.0;若铁粉足量,CO2的起始浓度为2.0mol•L-1,则平衡时CO2的浓度为$\frac{2}{3}$mol•L-1.
②下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号).
A.升高温度 B.增大压强
C.再充入一定量的CO2 D.再加入一定量铁粉
(3)对于可逆反应Fe(s)+CO2(g)?FeO(s)+CO(g),该反应的逆反应速率随时间变化的关系如图2.
①从图中看到,反应在t2时达平衡,在t1时改变了某种条件,改变的条件可能是AC.
A.升温 B.增大CO2浓度 C.使用催化剂
②如果在t3时从混合物中分离出部分CO,t4~t5时间段反应处于新平衡状态,请在图上画出t3~t5的V(逆)变化曲线.
①CO ②H2 ③CH4 ④HCHO ⑤CH3COOH ⑥HCOOH.
| A. | ①②⑥ | B. | ③④⑤ | C. | ①②④⑤ | D. | ②③⑤ |
| A. | 常温常压下,20gH218O中含有中子数目为12NA | |
| B. | 标准状况下,11.2LC2H6中含有极性键的数目为3.5NA | |
| C. | 1LpH=3的CH3COOH溶液中,含有H+的数目大于10-3NA | |
| D. | 1L1mol•L-1稀硝酸(还原产物为NO)与铁完全反应,转移电子数目为0.75NA |
