题目内容
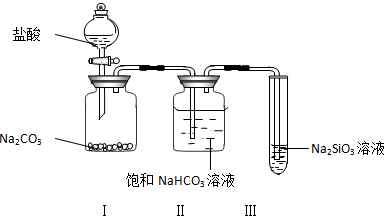
17.用适当的文字或化学符合填空(1)某溶液中可能含有HCO3-、Cl-、SO42-、NO3-、CO32-等阴离子.
当溶液中有大量H+存在时,则上述阴离子在溶液中不可能大量存在的是HCO3-、CO32-.
当溶液中有大量Ba2+存在时,则上述阴离子在溶液中不可能大量存在的是SO42-、CO32-.
(2)硅是现代信息材料重要的物质,写出工业上制取粗硅的方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(3)在铝制易拉罐中收集一满罐CO2,加入过量浓NaOH溶液,立即把口封闭,可以发现易拉罐变瘪了;过了一会儿易拉罐又鼓起来了.请用离子方程式描述变化过程CO2+2OH-═CO32-+H2O、Al2O3+2OH-═2AlO2-+H2O、2Al+2OH-+2H2O═2AlO2-+3H2↑.
(4)氰(CN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素,试写出(CN)2与水反应的化学方程式:(CN)2+H2O=HCN+HCNO.
(5)比较法是化学中研究物质性质的基本方法之一,请运用比较法解答下题,Na2O2可能与所有的常量气态非金属氧化物反应.如2Na2O2+2CO2═2Na2CO3+O2,Na2O2+CO═Na2CO3.
通过比较可知,当非金属元素处于高价时,其氧化物与Na2O2反应有O2生成;
试分别写出Na2O2与SO2、SO3反应的化学方程式:SO2+Na2O2=Na2SO4、2SO3+2Na2O2=2Na2SO4+O2↑.
(6)室温时,将盛有20mLNO2和O2混合气体的量筒倒立在盛有水的水槽中,充分反应后,量筒内残留气体3mL,则原混合气体中NO2的体积可能是13.6mL或17.8mL.
分析 (1)当溶液中有大量H+存在时,与HCO3-、CO32-离子不能大量共存;当溶液中有大量Ba2+存在时,与Ba2+离子反应的离子不能大量共存;
(2)碳能与二氧化硅反应生成硅单质;
(3)CO2能和氢氧化钠发生反应,氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,金属铝能和强碱反应生成氢气,利用瓶内压强变化来解释;
(4)根据氯气与水溶液的反应,类推(CN)2与水的反应;
(5)依据所给的例子可以知道:当非金属氧化物有高低价态时,过氧化钠与低价态的非金属氧化物发生化合反应,生成该非金属的最高价态的含氧酸盐,此时没有氧气产生;当非金属氧化物有高低价态时,过氧化钠与最高价态的非金属氧化物反应生成该非金属的最高价态的含氧酸盐和氧气;
(6)因3NO2+H2O═2HNO3+NO①,2NO+O2=2NO2②,两种反应不断交替进行,所以综合为①×2+②得:4NO2+O2+2H2O=4HNO3,①×2+②×3得:
4NO+3O2+2H2O=4HNO3,NO2、NO混合气体和O2通入倒立在水槽中盛有水的量筒内,充分反应后,量筒里液面上升,最终剩余气体,剩余气体为一氧化氮或氧气,据此分析解答.
解答 解:(1)当溶液中有大量H+存在时,HCO3-、CO32-离子与H+离子反应生成二氧化碳和水而不能大量共存,当溶液中有大量Ba2+存在时,SO42-、CO32-与Ba2+离子反应生成沉淀而不能大量共存,故答案为:HCO3-、CO32-;SO42-、CO32-;
(2)碳能与二氧化硅反应生成硅单质,化学反应方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(3)CO2能和氢氧化钠发生反应,CO2被吸收,使罐内气体压强减小而被外界大气压压瘪;氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,金属铝能和强碱反应生成氢气,导致罐内气体压强又增大而重新鼓起,二氧化碳和氢氧化钠反应的实质是:2OH-+CO2═CO32-+H2O,氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,反应的离子方程式为 Al2O3+2OH-═2AlO2-+H2O;金属铝能和强碱反应的实质是:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:CO2+2OH-═CO32-+H2O、Al2O3+2OH-═2AlO2-+H2O、2Al+2OH-+2H2O═2AlO2-+3H2↑;
(4)由Cl2+H2O=HCl+HClO可知,(CN)2的化学性质和卤素很相似,则(CN)2与水反应的化学方程式为(CN)2+H2O=HCN+HCNO,
故答案为:(CN)2+H2O=HCN+HCNO;
(5)二氧化硫是低价态的硫的氧化物,因此过氧化钠与二氧化硫发生化合反应,生成硫酸钠,反应的化学方程式为:SO2+Na2O2=Na2SO4,
三氧化硫是最高价态的硫的氧化物,因此过氧化钠与三氧化硫反应生成硫酸钠和氧气.反应的化学方程式为:2SO3+2Na2O2=2Na2SO4+O2↑;故答案为:SO2+Na2O2=Na2SO4、2SO3+2Na2O2=2Na2SO4+O2;
(6)3NO2+H2O═2HNO3+NO①,2NO+O2=2NO2②,两种反应不断交替进行,所以综合为①×2+②得:4NO2+O2+2H2O=4HNO3,①×2+②×3得:
4NO+3O2+2H2O=4HNO3,将20ml的NO2和O2通入倒立在水槽中盛有水的量筒内,充分反应后,量筒里液面上升,最终剩余3ml气体,设20ml的混合气体中两种气体的体积分别为X
当剩余3ml气体为氧气时:依据
4NO2+O2+2H2O=4HNO3,
4 1
X $\frac{X}{4}$
X+$\frac{X}{4}$+3=20
X=13,6ml
当剩余气体为NO,则剩余NO2为9ml
4NO2+O2+2H2O=4HNO3,
4 1
X $\frac{X}{4}$
X+$\frac{X}{4}$+9=20
X=8.8ml
原二氧化氮体积=8.8ml+9ml=17.8ml,故答案为:13.6mL或17.8mL.
点评 本题考查了氧化还原反应的有关计算,明确二氧化氮发生的反应是解本题关键,根据方程式中二氧化氮和一氧化氮和氧气关系式解答,题目难度中等.

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案| A. | 氯水中通入一定量的SO2气体可增强氯水的漂白性 | |
| B. | 因为SO2具有漂白性,所以它能使品红溶液、酸性高锰酸钾溶液褪色 | |
| C. | 已知酸性:H2SO4>HClO,则SO2通入漂白粉溶液中可生成次氯酸 | |
| D. | 紫色石蕊试液中通入SO2,溶液变红后不褪色 |
| A. | 水 | B. | 碘化钾溶液 | C. | 氯化亚铁溶液 | D. | 氢氧化钠溶液 |
| A. | 该反应是氧化还原反应 | B. | Cu是氧化剂 | ||
| C. | CO是还原剂 | D. | 该反应中有电子转移 |
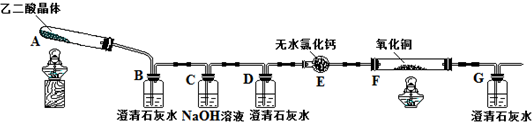
(1)证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊.
(2)证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊.
(3)实验结束后,装置F中黑色氧化铜完全变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法、现象、结论(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量红色固体,滴加稀硫酸,观察红色固体是否有溶解,溶液是否变蓝色.
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4、MnO2氧化.KMnO4和草酸钠在稀硫酸中反应的离子方程式是2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配制好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管 液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
| A. | 向水中加入NaHCO3溶液会抑制水的电离 | |
| B. | 35℃时纯水中c(H+)>c(OH-) | |
| C. | 向水中加入NaHSO4溶液会抑制水的电离 | |
| D. | c(H+)随着温度的升高而降低 |
| A. | 光导纤维的主要成分是二氧化硅 | |
| B. | SiO2不与水反应,所以二氧化硅不是酸性氧化物 | |
| C. | 装有烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱与二氧化硅反应生成硅酸钠而使瓶塞与瓶口黏在一起 | |
| D. | 晶体硅是良好的半导体材料 |