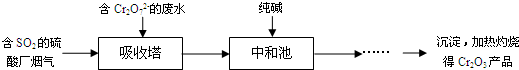
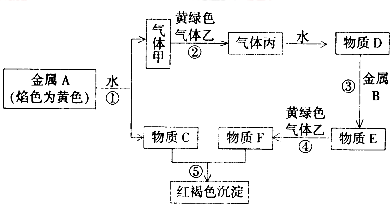
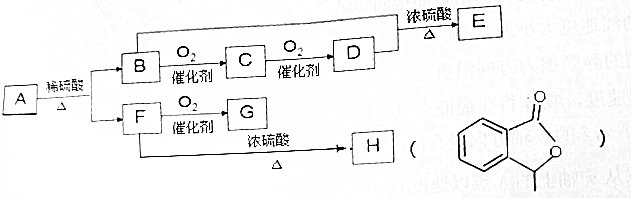
题目内容
2.某校化学小组学生利用下图所示装置进行“乙二酸(结构简式为HOOC-COOH,俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO.(图中夹持装置及尾气处理装置均已略去)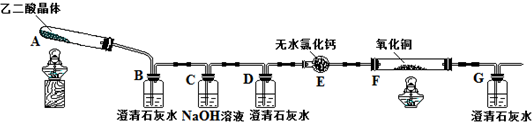
(1)证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊.
(2)证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊.
(3)实验结束后,装置F中黑色氧化铜完全变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法、现象、结论(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量红色固体,滴加稀硫酸,观察红色固体是否有溶解,溶液是否变蓝色.
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4、MnO2氧化.KMnO4和草酸钠在稀硫酸中反应的离子方程式是2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配制好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管 液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
分析 乙二酸(结构简式为HOOC-COOH,俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO流程:A装置乙二酸受热分解,B检验分解产物中有CO2,在后面的试验中要验证CO的存在,需要用NaOH溶液把乙二酸晶体受热分解生成的二氧化碳除掉,C装置除掉二氧化碳,D检验二氧化碳已经除尽,E干燥CO,F装置利用CO和CuO反应生成二氧化碳的性质,G装置检验二氧化碳的存在,从而证明CO的存在.
(1)利用二氧化碳能使澄清石灰水变浑浊的性质来检验,装置B中澄清石灰水变浑浊,;
(2)利用CO和CuO反应生成二氧化碳的性质,来检验二氧化碳的存在,从而证明CO的存在,装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊;
(3)Cu与稀硫酸不反应,Cu2O溶于稀硫酸生成铜单质和硫酸铜,取少量固体与试管中,加稀硫酸,若溶液变蓝色,说明有Cu2O,若溶液不变色,则不含有Cu2O;
(4)①KMnO4和草酸钠在稀硫酸中反应生成硫酸钾、硫酸锰、二氧化碳和水;根据方程式2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O计算;
②假设KMnO4溶液的浓度为c,根据方程式2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O计算.
解答 解:(1)二氧化碳通入装置B中,澄清石灰水变浑浊,说明有二氧化碳生成;
故答案为:装置B中澄清石灰水变浑浊;
(2)CO和CuO反应生成二氧化碳,二氧化碳使装置G中澄清石灰水变浑浊,先验证A中产生的二氧化碳被NaOH吸收完全,即装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊;
故答案为:装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊;
(3)Cu与稀硫酸不反应,Cu2O溶于稀硫酸生成铜单质和硫酸铜,则取少量红色固体于试管中,加稀硫酸,若溶液变蓝色,说明有Cu2O,若溶液不变色,则不含有Cu2O,
故答案为:取少量红色固体,滴加稀硫酸,观察红色固体是否有溶解,溶液是否变蓝色;
(4)①KMnO4和草酸钠在稀硫酸中反应生成硫酸钾、硫酸钠、硫酸锰、二氧化碳和水,则反应的离子方程式为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;
故答案为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;
②根据三次试验数据计算高锰酸钾溶液体积平均值为=$\frac{16.02+16.0+16.01}{3}$=16.01mL,假设KMnO4溶液的浓度为c,n(C2O42-)=$\frac{0.2000g}{134g/mol}$,
则:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
2mol 5mol
c×0.01601L $\frac{0.2000g}{134g/mol}$
解得c=$\frac{0.2000g×2mol}{5mol×134g/mol×0.01601L}$,
故答案为:$\frac{0.2000g×2mol}{5mol×134g/mol×0.01601L}$.
点评 本题以乙二酸的分解为背景考查了实验方案设计、氧化还原反应滴定、化学计算等,题目较为综合且具有一定难度,做题时注意把握常见物的性质及检验方法,侧重于考查学生的实验探究能力和计算能力,题目难度中等.

| A. | 原子数 | B. | 分子数 | C. | 体积 | D. | 物质的量 |
| A. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.3 kJ/mol | |
| B. | 2SO2(g)+O2(g)?SO3(l)△H=-196.6 kJ/mol | |
| C. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-122.9 kJ/mol | |
| D. | 2SO2(g)+O2(g)?SO3(g)△H=+196.6 kJ/mol |
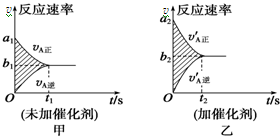 可逆反应mA(g)+nB(g)?pC(g)+gD(g)的v-t图象如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.
可逆反应mA(g)+nB(g)?pC(g)+gD(g)的v-t图象如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2
⑤t1=t2⑥t1>t2 ⑦两图中阴影部分面积
相等 ⑧图乙中阴影部分面积更大以上所列正确的为 ( )
A.②④⑥⑦B.②④⑤⑧
C.②③⑤⑦D.②③⑥⑧
| A. | ②④⑥⑦ | B. | ②④⑤⑧ | C. | ②③⑤⑦ | D. | ②③⑥⑧ |
| A. | $\frac{1}{8}$ | B. | $\frac{3}{8}$ | C. | $\frac{1}{4}$ | D. | $\frac{3}{4}$ |