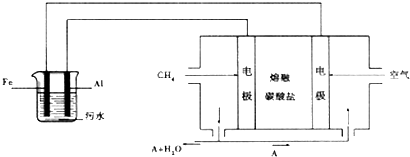
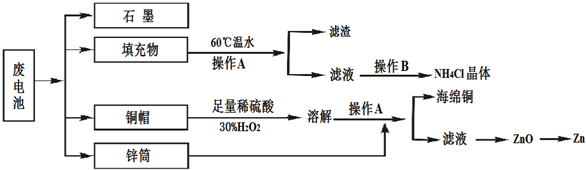
题目内容
9.水的电离过程为H2O?H++OH-,不同温度下其平衡常数为KW(25℃)=1.0×10-14,K(35℃)=2.1×10-14.下列叙述正确的是( )| A. | 向水中加入NaHCO3溶液会抑制水的电离 | |
| B. | 35℃时纯水中c(H+)>c(OH-) | |
| C. | 向水中加入NaHSO4溶液会抑制水的电离 | |
| D. | c(H+)随着温度的升高而降低 |
分析 由水在不同温度下的平衡常数得知,水的电离是吸热过程,据此判断即可.
解答 解:A.水中存在:H2O?H++OH-,向水中加入NaHCO3溶液,碳酸氢根结合水电离出的氢离子,促进水的电离,故A错误;
B.纯水溶液中,存在c(H+)=c(OH-),与所处的温度无关,故B错误;
C.水中存在:H2O?H++OH-,向水中加入NaHSO4溶液,此盐电离出的氢离子抑制水的电离,故C正确;
D.由题给信息可知,水的电离是吸热过程,温度升高,氢离子浓度增大,故D错误,故选C.
点评 本题考查了水的电离,注意水的电离过程是吸热反应,温度升高会促进水的电离,本题难度不大.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
14.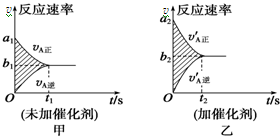 可逆反应mA(g)+nB(g)?pC(g)+gD(g)的v-t图象如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.
可逆反应mA(g)+nB(g)?pC(g)+gD(g)的v-t图象如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2
⑤t1=t2⑥t1>t2 ⑦两图中阴影部分面积
相等 ⑧图乙中阴影部分面积更大以上所列正确的为 ( )
A.②④⑥⑦B.②④⑤⑧
C.②③⑤⑦D.②③⑥⑧
 可逆反应mA(g)+nB(g)?pC(g)+gD(g)的v-t图象如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.
可逆反应mA(g)+nB(g)?pC(g)+gD(g)的v-t图象如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2
⑤t1=t2⑥t1>t2 ⑦两图中阴影部分面积
相等 ⑧图乙中阴影部分面积更大以上所列正确的为 ( )
A.②④⑥⑦B.②④⑤⑧
C.②③⑤⑦D.②③⑥⑧
| A. | ②④⑥⑦ | B. | ②④⑤⑧ | C. | ②③⑤⑦ | D. | ②③⑥⑧ |
1.已知反应I2(g)+H2(g)?2HI(g),下列关于如图所示现象的说法正确的( )


| A. | 加压后,该反应平衡向左移 | B. | 加压后,c(I2)增大 | ||
| C. | 压强变化时,c(HI)不变 | D. | 加压后,颜色变浅 |
18.下列叙述中,正确的是( )
| A. | 在多电子的原子里,能量高的电子通常在离核近的区域活动 | |
| B. | 核外电子总是先排在能量低的电子层上 | |
| C. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| D. | 微粒的最外层只能是8个或2个电子才稳定 |