题目内容
9.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑩九种元素在周期表中的位置.| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 1 | ① | ⑩ | ||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑤ | ⑨ |
(1)在表里填写①~⑩元素符号,写出元素符号①H、③Mg、⑧Cl.
(2)其中化学性质最不活泼的是He(填元素符号).
(3)在②、③、④三种元素的氧化物对应的水化物中,碱性最强的是NaOH(填化学式).
(4)元素①、②、⑤按原子半径由大到小的顺序依次为K>Na>H(填元素符号)
(5)元素⑥的氢化物的化学式是NH3,该氢化物溶于水,所得溶液的pH>(填“<”、“>”或“=”)7.
(6)元素②与元素⑧形成的化合物的电子式是
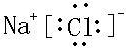 ,高温下灼烧该化合物火焰呈黄色.
,高温下灼烧该化合物火焰呈黄色.(7)Al(填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应.
分析 (1)由元素在周期表中位置,可知①为H、②为Na、③为Mg、④为Al、⑤为K、⑥为N、⑦为F、⑧为Cl、⑨为Br、⑩为He;
(2)稀有气体化学性质最不活泼;
(3)金属性越强,最高价氧化物对应水化物的碱性越强;
(4)根据同主族自上而下原子半径增大判断;
(5)元素⑥的氢化物为NH3;氨气的水溶液呈碱性;
(6)元素钠与元素氯形成的化合物氯化钠,氯化钠的电子式为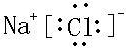 ,高温下灼烧该化合物火焰呈黄色;
,高温下灼烧该化合物火焰呈黄色;
(7)某元素单质的氧化产物既可以和盐酸反应又可以和氢氧化钠溶液反应,应为Al;
解答 解:(1)由元素在周期表中位置,可知①为H、②为Na、③为Mg、④为Al、⑤为K、⑥为N、⑦为F、⑧为Cl、⑨为Br、⑩为He,
故答案为:①H、②Na、③Mg、④Al、⑤K、⑥N、⑦F、⑧Cl、⑨Br、⑩He;H;Mg;Cl;
(2)稀有气体He的化学性质最不活泼,
故答案为:He;
(3)金属性Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:NaOH>Mg(OH)2>Al(OH)3,
故答案为:NaOH;
(4)同主族自上而下原子半径逐渐增大,故三者的原子半径大小为:K>Na>H,
故答案为:K>Na>H;
(5)元素⑥的氢化物为NH3;氨气的水溶液呈碱性,所以所得溶液的pH大于7,故答案为:NH3;>;
(6)元素钠与元素氯形成的化合物氯化钠,氯化钠的电子式为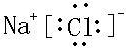 ,高温下灼烧该化合物火焰呈黄色,故答案为:
,高温下灼烧该化合物火焰呈黄色,故答案为: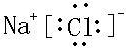 ;黄;(7)某元素单质的氧化产物既可以和盐酸反应又可以和氢氧化钠溶液反应,应为Al,故答案为:Al.
;黄;(7)某元素单质的氧化产物既可以和盐酸反应又可以和氢氧化钠溶液反应,应为Al,故答案为:Al.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,熟练掌握原子结构与元素周期表、元素周期律的关系为解答关键,试题充分考查了学生的分析、理解能力及灵活应用基础知识的能力.

| A. | 2.5 ax/b | B. | 5.6 ax/b | C. | 11.2 ax/b | D. | 22.4 ax/b |
| A. | 10B20为硼元素的一种原子 | B. | 10B20为硼元素的一种单质 | ||
| C. | 10B的中子数比核外电子数多 | D. | 10B的原子核外电子排布为 |
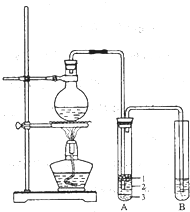 某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:
某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:NaBr+H2SO4→HBr+NaHSO4
CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O
化学兴趣小组根据实验原理设计如图的装置.
根据题意完成下列填空:有关数据列表如下:
| 乙醇 | 溴乙烷 | |
| 状态 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.8 | 1.4 |
| 沸点/℃ | 78.5 | 119.0 |
| 熔点/℃ | -l30 | 38.4 |
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶 e.滴定管
(2)将生成物导入盛有冰水混合物的试管A中,试管A中的物质分为三层(如图所示),产物在第3层;
(3)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质应加入d选填编号)然后再进行分液一步操作即可;
a.无水氯化钙 b.硝酸银溶液 c.四氯化碳 d.亚硫酸钠溶液
(4)实验过程中,同学发现仪器连接部分有漏气现象,老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:反应会产生Br2,腐蚀橡胶;
(5)假设最初取用的无水乙醇是57.5mL,最后得到的纯净的溴乙烷是52.0mL,则溴乙烷的产率为66.8%.
| A. | 利用盖斯定律可计算某些难以直接测量的反应焓变 | |
| B. | 如果一个热化学方程式可通过其他几个热化学方程式相加减而得到,则该反应的焓变可由相对应的热化学方程式的焓变相加减而得到 | |
| C. | 当同一个化学反应以不同的途径完成时,反应的焓变也是不同的 | |
| D. | 对于放热反应,放出的热量越多,焓变越小 |
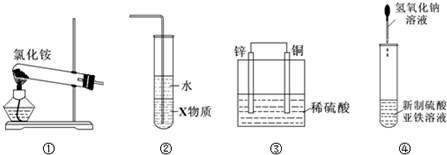
| A. | 实验室用装置①制取氨气 | |
| B. | 装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸 | |
| C. | 装置③是原电池,锌电极为负极,发生还原反应 | |
| D. | 装置④可用于制备氢氧化亚铁并观察其颜色 |
| A. | 3:4 | B. | 4:3 | C. | 3:2 | D. | 2:3 |
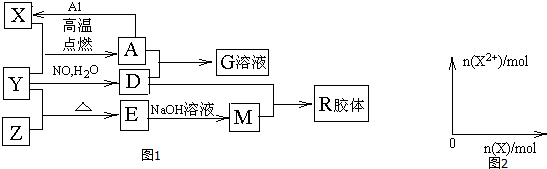
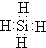 .
.