题目内容
18.相同质量的Mg和Al分别投入足量的盐酸中,产生的气体在标准状况下的体积比为( )| A. | 3:4 | B. | 4:3 | C. | 3:2 | D. | 2:3 |
分析 镁铝合金与盐酸发生:Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,相同质量可设合金中Mg为27mol,Al为24mol,求生成氢气的体积,据此解答;
解答 解:由反应方程式Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,相同质量,可设合金中Mg为27mol,Al为24mol,所以生成氢气的物质的量分别为:27mol,24×1.5mol=36mol,标准状况下体积之比等于物质的量之比:27:36=3:4,故选A.
点评 本题考查化学方程式的计算,侧重于学生的分析能力和计算能力的考查,巧设物质的量,符合质量相等,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.《后汉书•郡国志》中记载:“石出泉水…其水有肥,燃之极明,不可食,县人谓之石漆.”《酉阳杂俎》一书:“高奴县石脂水,水腻,浮上如漆,采以膏车及燃灯极明.”这里的“石漆”“石脂水”是指( )
| A. | 油脂 | B. | 油漆 | C. | 石油 | D. | 煤焦油 |
9.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑩九种元素在周期表中的位置.
请回答:(以下用相应的元素符号回答问题)
(1)在表里填写①~⑩元素符号,写出元素符号①H、③Mg、⑧Cl.
(2)其中化学性质最不活泼的是He(填元素符号).
(3)在②、③、④三种元素的氧化物对应的水化物中,碱性最强的是NaOH(填化学式).
(4)元素①、②、⑤按原子半径由大到小的顺序依次为K>Na>H(填元素符号)
(5)元素⑥的氢化物的化学式是NH3,该氢化物溶于水,所得溶液的pH>(填“<”、“>”或“=”)7.
(6)元素②与元素⑧形成的化合物的电子式是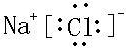 ,高温下灼烧该化合物火焰呈黄色.
,高温下灼烧该化合物火焰呈黄色.
(7)Al(填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 1 | ① | ⑩ | ||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑤ | ⑨ |
(1)在表里填写①~⑩元素符号,写出元素符号①H、③Mg、⑧Cl.
(2)其中化学性质最不活泼的是He(填元素符号).
(3)在②、③、④三种元素的氧化物对应的水化物中,碱性最强的是NaOH(填化学式).
(4)元素①、②、⑤按原子半径由大到小的顺序依次为K>Na>H(填元素符号)
(5)元素⑥的氢化物的化学式是NH3,该氢化物溶于水,所得溶液的pH>(填“<”、“>”或“=”)7.
(6)元素②与元素⑧形成的化合物的电子式是
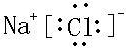 ,高温下灼烧该化合物火焰呈黄色.
,高温下灼烧该化合物火焰呈黄色.(7)Al(填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应.
6.短周期元素A和元素B,已知A原子最外层电子数为a,次外层电子数为b,B原子的L层电子数为(a+b),M层电子数为(a-b),则下列叙述不正确的是( )
| A. | 两元素可形成化合物BA2 | |
| B. | A元素位于元素周期表第二周期第VIA族 | |
| C. | A、B两元素形成的化合物能与碳反应形成单质B | |
| D. | A、B两元素形成的化合物是两性化合物 |
13.下列说法中不正确的是( )
| A. | 铜丝燃烧法可确定有机物中是否存在氮、氯和硫等元素 | |
| B. | 减压分馏、常压分馏都是物理变化 | |
| C. | 甲烷与氯气在光照条件下反应是一个自由基型链反应 | |
| D. | 液化石油气、天然气都是混合物 |
8.反应N2+O2═2NO,在密闭容器中进行,下列条件能加快该反应的速率的是( )
| A. | 增大容器体积 | B. | 体积不变,充入N2使压强增大 | ||
| C. | 体积不变,充入He使压强增大 | D. | 压强不变,充入N2使体积增大 |
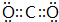 .D2A2中所含化学键类型为非极性共价键和离子键.
.D2A2中所含化学键类型为非极性共价键和离子键. .
.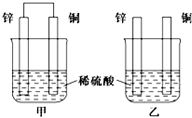 (1)将纯锌片和纯铜片按如图方式插入相同浓度的稀硫酸中一段时间,回答下列问题:
(1)将纯锌片和纯铜片按如图方式插入相同浓度的稀硫酸中一段时间,回答下列问题: