题目内容
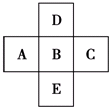
16.表是元素周期表的一部分,请回答有关问题:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)表中能形成两性氢氧化物的元素其单质与⑨最高价氧化物的水化物反应的化学方程式2Al+2KOH+2H2O=2KAlO2+3H2↑.
(3)④元素与⑦元素形成化合物的电子式
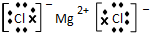 .
.(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是HClO4(填化学式).
(5)在⑨与④的单质中,化学性质较活泼的是K,①、②的气态氢化物中,比较稳定的是NH3(填化学式).
分析 由元素在周期表中的位置可知,①为C,②为N,③为F,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br.
(1)稀有气体Ar的化学性质最不活泼;
(2)能形成两性氢氧化物的元素为Al,与⑨最高价氧化物的水化物为KOH,二者反应生成偏铝酸钾与氢气;
(3)④元素与⑦元素形成化合物为MgCl2,由镁离子与氯离子构成;
(4)最高价氧化物的水化物中酸性最强的是高氯酸;
(5)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,金属性越强,金属单质越活泼,非金属性越强,氢化物越稳定.
解答 解:由元素在周期表中的位置可知,①为C,②为N,③为F,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br.
(1)稀有气体Ar的化学性质最不活泼,原子结构示意图为: ,
,
故答案为: ;
;
(2)能形成两性氢氧化物的元素为Al,与⑨最高价氧化物的水化物为KOH,二者反应生成偏铝酸钾与氢气,反应方程式为:2Al+2KOH+2H2O=2KAlO2+3H2↑,
故答案为:2Al+2KOH+2H2O=2KAlO2+3H2↑;
(3)④元素与⑦元素形成化合物为MgCl2,由镁离子与氯离子构成,电子式为: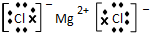 ,
,
故答案为: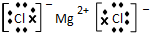 ;
;
(4)最高价氧化物的水化物中酸性最强的是HClO4,
故答案为:HClO4;
(5)同周期自左而右金属性减弱,同主族自上而下金属性增强,故K的活泼性更强,
同周期自左而右非金属性增强,非金属性越强,氢化物越稳定,故NH3稳定性更强,
故答案为:K;NH3.
点评 本题考查元素周期表与元素周期律,侧重对化学用语与元素周期律的考查,熟练掌握元素周期表的结构.

练习册系列答案
相关题目
18.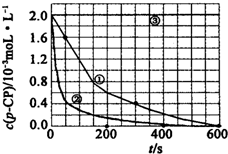 (一)Fenton法常用于处理含有难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K下设计如下对比实验(其余实验条件见下表):
(一)Fenton法常用于处理含有难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K下设计如下对比实验(其余实验条件见下表):
(1)编号③的实验目的是探究pH对降解速率的影响.
(2)实验测得不同实验编号中p-CP的浓度随时间变化的关系如图所示.请根据实验①曲线,计算降解反应在50-300s内的平均反应速率v(p-CP)=4.8×10-6mol•L-1•s-1.
(3)实验①②表明,温度与该降解反应速率的关系是温度越高,降解反应速率越快.
(二)已知Fe3+和I-在水溶液中的反应为2I-+2Fe3+=2Fe2++I2.正向反应速率和I-、Fe3+的浓度关系为v=kcm(I-)cn(Fe3+)(k为常数)
(4)请分析下表提供的数据回答以下问题:
①在v=kcm(I-)cn(Fe3+)中,m、n的值为C.(选填A、B、C、D)
A.m=1,n=1 B.m=1,n=2 C.m=2,n=1 D.m=2,n=2
②I-浓度对反应速率的影响>Fe3+浓度对反应速率的影响(填“<”、“>”或“=”).
(三)一定温度下,反应FeO(s)+CO(g)?Fe(s)+CO2(g)的化学平衡常数为3.0,该温度下将2mol FeO、4mol CO、5mol Fe、6mol CO2加入容积为2L的密闭容器中反应.请通过计算回答:
(5)v(正)>v(逆)(填“>”、“<”或“=”);若将5mol FeO、4mol CO加入同样的容器中,在相同温度下达到平衡,则CO的平衡转化率为75%.
 (一)Fenton法常用于处理含有难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K下设计如下对比实验(其余实验条件见下表):
(一)Fenton法常用于处理含有难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K下设计如下对比实验(其余实验条件见下表):| 实验序号 | 实验目的 | T/K | pH | c/10-3mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照物 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | 3 | 6.0 | 0.30 |
| ③ | 298 | 10 | 6.0 | 0.30 | |
(2)实验测得不同实验编号中p-CP的浓度随时间变化的关系如图所示.请根据实验①曲线,计算降解反应在50-300s内的平均反应速率v(p-CP)=4.8×10-6mol•L-1•s-1.
(3)实验①②表明,温度与该降解反应速率的关系是温度越高,降解反应速率越快.
(二)已知Fe3+和I-在水溶液中的反应为2I-+2Fe3+=2Fe2++I2.正向反应速率和I-、Fe3+的浓度关系为v=kcm(I-)cn(Fe3+)(k为常数)
(4)请分析下表提供的数据回答以下问题:
| c(I-)/(mol•L-1) | c(Fe3+)/(mol•L-1) | v/(mol•L-1•s-1) | |
| (1) | 0.20 | 0.80 | 0.032k |
| (2) | 0.60 | 0.40 | 0.144k |
| (3) | 0.80 | 0.20 | 0.128k |
A.m=1,n=1 B.m=1,n=2 C.m=2,n=1 D.m=2,n=2
②I-浓度对反应速率的影响>Fe3+浓度对反应速率的影响(填“<”、“>”或“=”).
(三)一定温度下,反应FeO(s)+CO(g)?Fe(s)+CO2(g)的化学平衡常数为3.0,该温度下将2mol FeO、4mol CO、5mol Fe、6mol CO2加入容积为2L的密闭容器中反应.请通过计算回答:
(5)v(正)>v(逆)(填“>”、“<”或“=”);若将5mol FeO、4mol CO加入同样的容器中,在相同温度下达到平衡,则CO的平衡转化率为75%.
19.下列指定反应的离子方程式正确的是( )
| A. | 碳酸的电离子方程式:H2CO3═2H++CO32- | |
| B. | 过量铁粉与稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 次氯酸钠溶液中滴入浓盐酸产生Cl2:2H++Cl-+ClO-═Cl2↑+H2O | |
| D. | (NH4)2Fe(SO4)2溶液中加入过量NaOH溶液并加热:NH4++Fe2++3OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+Fe(OH)2↓+H2O |
11.下列说法不正确的是( )
| A. | 比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加K3[Fe(CN)6]沉淀,观察铁钉周围出现蓝色沉淀的快慢 | |
| B. | 探究温度对化学反应速率影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 | |
| C. | 欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(试纸)为:中和滴定实验、pH试纸 | |
| D. | 从海带中提取碘,可将灰化后的海带加入水中煮沸一段时间后过滤,向滤液中滴入几滴硫酸,再加入适量H2O2溶液氧化,最后加入CCl4萃取分离 |
1.下列说法中正确的是( )
| A. | 原电池中阴离子向正极移动 | |
| B. | 原电池是将电能转化为化学能的装置 | |
| C. | 原电池中电子流出的极为负极,发生氧化反应 | |
| D. | 原电池正极上发生氧化反应 |
6.下列有关化学反应能量变化的叙述中,正确的是( )
| A. | 只要是在加热条件下进行的反应一定是吸热反应 | |
| B. | 一种能量形式可以转化为另外的能量,所以任何反应都可以把化学能转化为电能 | |
| C. | 中和反应和燃烧是放热反应,Ba(OH)2•8H2O与NH4Cl的反应是吸热反应 | |
| D. | 只要反应物的总能量高于生成物的总能量,在任何条件下该反应就能够发生 |