题目内容
1.下列说法中正确的是( )| A. | 原电池中阴离子向正极移动 | |
| B. | 原电池是将电能转化为化学能的装置 | |
| C. | 原电池中电子流出的极为负极,发生氧化反应 | |
| D. | 原电池正极上发生氧化反应 |
分析 A、根据原电池的工作原理:阴离子向负极移动;
B、根据原电池的能量转化知识来回答;
C、原电池中电子流出的极为负极,发生氧化反应;
D、根据原电池的工作原理:正极上发生还原反应.
解答 解:A、原电池工作时,电解质中的阴离子向负极移动,故A错误;
B、原电池是将化学能转化为电能的装置,故B错误;
C、原电池中电子流出的极为负极,发生氧化反应,故C正确;
D、原电池的工作时,正极上发生还原反应,负极上发生氧化反应,故D错误.
故选C.
点评 本题考查学生原电池的工作原理和能量转化知识,属于教材知识的考查,较简单.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
3.下列说法正确的是( )
| A. | 光伏发电是将化学能转化为电能 | |
| B. | 钢铁吸氧腐蚀正极的电极反应式是O2+4e-+2H2O=4OH- | |
| C. | 通过电解NaCl水溶液的方法生产金属钠 | |
| D. | 铅蓄电池的负极材料是Pb,正极材料是PbSO4 |
9.甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如表(所取溶液体积均为5mL):
(1)其他条件不变时:探究温度对化学反应速率的影响,应选择①④(填实验编号).
(2)Na2S2O3和H2SO4反应的化学方程式为Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.
(3)若实验①中加入反应物各5mL后加入10mL水,出现浑浊的时间为t1,实验②中加入反应物各5mL后加入30mL水,出现浑浊的时间为t2,则t1=t2(选填“>”、“<”或“=”)
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
(2)Na2S2O3和H2SO4反应的化学方程式为Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.
(3)若实验①中加入反应物各5mL后加入10mL水,出现浑浊的时间为t1,实验②中加入反应物各5mL后加入30mL水,出现浑浊的时间为t2,则t1=t2(选填“>”、“<”或“=”)
16.表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素其原子结构示意图为 .
.
(2)表中能形成两性氢氧化物的元素其单质与⑨最高价氧化物的水化物反应的化学方程式2Al+2KOH+2H2O=2KAlO2+3H2↑.
(3)④元素与⑦元素形成化合物的电子式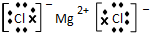 .
.
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是HClO4(填化学式).
(5)在⑨与④的单质中,化学性质较活泼的是K,①、②的气态氢化物中,比较稳定的是NH3(填化学式).
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)表中能形成两性氢氧化物的元素其单质与⑨最高价氧化物的水化物反应的化学方程式2Al+2KOH+2H2O=2KAlO2+3H2↑.
(3)④元素与⑦元素形成化合物的电子式
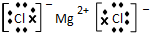 .
.(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是HClO4(填化学式).
(5)在⑨与④的单质中,化学性质较活泼的是K,①、②的气态氢化物中,比较稳定的是NH3(填化学式).
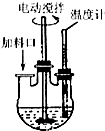 实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.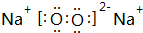 (写一种);
(写一种);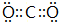 (写一种).
(写一种).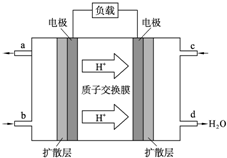 人们应用原电池原理制作了多种电池以满足不同的需要.电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:
人们应用原电池原理制作了多种电池以满足不同的需要.电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题: