题目内容
18.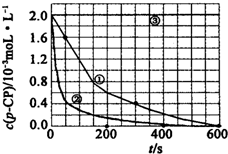 (一)Fenton法常用于处理含有难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K下设计如下对比实验(其余实验条件见下表):
(一)Fenton法常用于处理含有难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K下设计如下对比实验(其余实验条件见下表):| 实验序号 | 实验目的 | T/K | pH | c/10-3mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照物 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | 3 | 6.0 | 0.30 |
| ③ | 298 | 10 | 6.0 | 0.30 | |
(2)实验测得不同实验编号中p-CP的浓度随时间变化的关系如图所示.请根据实验①曲线,计算降解反应在50-300s内的平均反应速率v(p-CP)=4.8×10-6mol•L-1•s-1.
(3)实验①②表明,温度与该降解反应速率的关系是温度越高,降解反应速率越快.
(二)已知Fe3+和I-在水溶液中的反应为2I-+2Fe3+=2Fe2++I2.正向反应速率和I-、Fe3+的浓度关系为v=kcm(I-)cn(Fe3+)(k为常数)
(4)请分析下表提供的数据回答以下问题:
| c(I-)/(mol•L-1) | c(Fe3+)/(mol•L-1) | v/(mol•L-1•s-1) | |
| (1) | 0.20 | 0.80 | 0.032k |
| (2) | 0.60 | 0.40 | 0.144k |
| (3) | 0.80 | 0.20 | 0.128k |
A.m=1,n=1 B.m=1,n=2 C.m=2,n=1 D.m=2,n=2
②I-浓度对反应速率的影响>Fe3+浓度对反应速率的影响(填“<”、“>”或“=”).
(三)一定温度下,反应FeO(s)+CO(g)?Fe(s)+CO2(g)的化学平衡常数为3.0,该温度下将2mol FeO、4mol CO、5mol Fe、6mol CO2加入容积为2L的密闭容器中反应.请通过计算回答:
(5)v(正)>v(逆)(填“>”、“<”或“=”);若将5mol FeO、4mol CO加入同样的容器中,在相同温度下达到平衡,则CO的平衡转化率为75%.
分析 (一)(1)对比实验①③可知除PH值不同外,其他条件完全相同,得出实验③的目的;
(2)根据反应速率公式v=$\frac{△c}{△t}$;
(3)根据实验①②的温度高低和曲线的斜率大小来回答;
(二)(4)①将表中的三组数据代入公式v=kcm(I-)cn(Fe3+),计算m和n的值;
②根据m、n的大小确定影响大小;
(三)(5)根据Qc与K的大小来判断,用三行式计算转化率.
解答 解:(一)(1)对比实验①③可知除PH值不同外,其他条件完全相同,所以实验③的目的是探究pH对降解速率的影响,
故答案为:探究pH对降解速率的影响;
(2)应在50-300s内的平均反应速率v(p-CP)=$\frac{△c}{△t}$=$\frac{(1.6-0.4)×1{0}^{-3}mol•{L}^{-1}}{250s}$=4.8×10-6 mol•L-1•s-1,
故答案为:4.8×10-6mol•L-1•s-1;
(3)根据实验①②相比,实验②的温度更高,②的曲线的斜率更大,降解反应速率大,
故答案为:温度越高,降解反应速率越快;
(二)(4)①将表中的三组数据代入公式v=kcm(I-)cn(Fe3+),
得0.20m×0.80n=0.032K,
0.60m×0.40n=0.144K,
0.80m×0.20n=0.128K,
解之得:m=2,n=1,
故答案为:C;
②m>n,所以I-浓度对反应速率的影响大,
故答案为:>;
(三)(5)该温度下将2mol FeO、4mol CO、5mol Fe、6mol CO2加入容积为2L的密闭容器中反应,发生可逆反应FeO(s)+CO(g)?Fe(s)+CO2(g),
根据Qc=$\frac{c(C{O}_{2})}{c(CO)}$=$\frac{\frac{6mol}{2L}}{\frac{4mol}{2L}}$=1.5,比该温度下的平衡常数K=3.0小,所以此时反应正向进行,正反应占优势,v(正)>v(逆);
若将5mol FeO、4mol CO加入同样的容器中,在相同温度下达到平衡,CO的初始浓度为4mol÷2L=2mol/L,设平衡时一氧化碳转化了x mol/L,根据三行式:
FeO(s)+CO(g)?Fe(s)+CO2(g),
初始浓度:2mol/L 0mol/L
变化浓度:xmol/L xmol/L
平衡浓度:(2-x)mol/L xmol/L
K=$\frac{c(C{O}_{2})}{c(CO)}$=$\frac{x}{2-x}$=3.0,解得x=1.5 mol/L,则CO的平衡转化率为=$\frac{CO变化浓度}{CO初始浓度}$×100%=$\frac{1.5mol•{L}^{-1}}{2mol•{L}^{-1}}$=75%,
故答案为:>;75%.
点评 本题考查学生化学平衡状态以及化学反应速率知识,要求学生具有分析和解决问题的能力,注意对表格中数据的处理,题目综合性强,难度较大.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案| A. | 硝酸型酸雨的形成:3NO2+H2O═2HNO3+NO | |
| B. | 用Fe2(SO4)3做净水剂:Fe3++3H2O?Fe(OH)3+3H+ | |
| C. | 水垢中的CaSO4用Na2CO3溶液处理:Ca2++CO32-═CaCO3↓ | |
| D. | 向5 mL 0.1mol•L-1的K2Cr2O7溶液中滴加5滴浓硫酸,溶液橙色变深:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+ |
| A. | 光伏发电是将化学能转化为电能 | |
| B. | 钢铁吸氧腐蚀正极的电极反应式是O2+4e-+2H2O=4OH- | |
| C. | 通过电解NaCl水溶液的方法生产金属钠 | |
| D. | 铅蓄电池的负极材料是Pb,正极材料是PbSO4 |
| A. | NA个Fe(OH)3胶体粒子的质量为107g | |
| B. | 标准状况下,1L液态水中含有的H+数目为10-7NA | |
| C. | 14g分子式为CnH2n的链烃中含有的碳碳双键的数目为NA/n | |
| D. | 1 mol冰醋酸和l mo1乙醇经酯化反应可生成H2O分子数为NA |
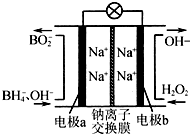 硼氢化钠(NaBH4)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图.下列说法正确的是( )
硼氢化钠(NaBH4)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图.下列说法正确的是( )| A. | 电极a为正极,b为负极 | |
| B. | 放电时,Na+从b极区移向a极区 | |
| C. | 电极b上发生的电极反应为H2O2+2e-═2OH- | |
| D. | 每生成1 mol BO2-转移6 mol电子 |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)表中能形成两性氢氧化物的元素其单质与⑨最高价氧化物的水化物反应的化学方程式2Al+2KOH+2H2O=2KAlO2+3H2↑.
(3)④元素与⑦元素形成化合物的电子式
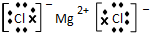 .
.(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是HClO4(填化学式).
(5)在⑨与④的单质中,化学性质较活泼的是K,①、②的气态氢化物中,比较稳定的是NH3(填化学式).
 (1)根据无机含氧酸的酸性规律,将下列四种无机含氧酸按酸性相近两两组成一组,它们是①和④;②和③.(用序号表示)
(1)根据无机含氧酸的酸性规律,将下列四种无机含氧酸按酸性相近两两组成一组,它们是①和④;②和③.(用序号表示)
 .
. .
.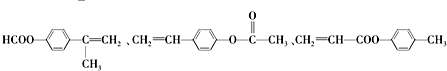 .
. .
.