题目内容
6.某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验: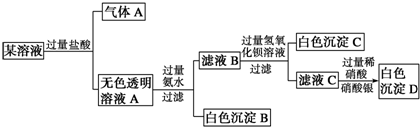
下列说法正确的是( )
| A. | 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl-四种离子 | |
| B. | 原溶液中是否存在Na+无法判断 | |
| C. | 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+ | |
| D. | 生成沉淀B的离子方程式为:Al3++3OH-═Al(OH)3↓ |
分析 向其中加入过量盐酸,有气体A生成,并得到无色透明溶液,则溶液中含有CO32-离子,没有Fe3+离子,CO32离子与Cu2+、Ba2+离子不能共存,则不存在Cu2+、Ba2+离子,根据溶液呈电中性,一定含有Na+离子;
向溶液A中加入过量氨水,产生白色沉淀,该沉淀为Al(OH)3,则原溶液中含有AlO2-离子;
滤液B中加入过量氢氧化钡溶液,产生白色沉淀,该沉淀为BaSO4,说明原溶液中含有SO42-离子;
向滤液C中加入过量稀硝酸,再加入硝酸银溶液,产生白色沉淀,该沉淀是AgCl,但不能证明原溶液中是否含有Cl-离子,因为在第一步中加入盐酸,以此解答该题.
解答 解:向其中加入过量盐酸,有气体A生成,并得到无色透明溶液,则溶液中含有CO32-离子,没有Fe3+离子,CO32离子与Cu2+、Ba2+离子不能共存,则不存在Cu2+、Ba2+离子,根据溶液呈电中性,一定含有Na+离子;
向溶液A中加入过量氨水,产生白色沉淀,该沉淀为Al(OH)3,则原溶液中含有AlO2-离子;
滤液B中加入过量氢氧化钡溶液,产生白色沉淀,该沉淀为BaSO4,说明原溶液中含有SO42-离子;
向滤液C中加入过量稀硝酸,再加入硝酸银溶液,产生白色沉淀,该沉淀是AgCl,但不能证明原溶液中是否含有Cl-离子,因为在第一步中加入盐酸,
A.由以上分析可知,原溶液中一定存在的离子为:AlO2-、CO32-、SO42-、Na+,故A错误;
B.根据溶液呈电中性,一定含有Na+离子,故B错误;
C.由以上分析可知,原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+,故C正确;
D.生成沉淀B的离子方程式为:Al3++3NH3•H20═3NH4++Al(OH)3↓,故D错误;
故选C.
点评 本题考查无机物的推断,侧重考查学生离子共存和离子反应知识,是现在高考的热点和难点,题目难度中等,注意把握离子的性质以及检验方法,试题充分考查了学生的分析、理解能力.

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案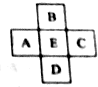 原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、O族元素除外)( )
原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、O族元素除外)( )| A. | 4x | B. | 4x+6 | C. | 4x+10 | D. | 4x+14 |
| A. | Na2SO3溶液(HCl酸化的BaCl2溶液) | B. | 氯水(AgNO3溶液) | ||
| C. | 漂白粉(稀硝酸) | D. | NaOH溶液(Ba(OH)2溶液) |
| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | NH4+ |
| A. | 蛋白质、淀粉、纤维素、葡萄糖等都能在人体内水解并提供能量 | |
| B. | 将甲烷和乙烯的混合气体通过盛有溴水的洗气瓶,即可提纯甲烷 | |
| C. | C2H6与氯气发生取代反应,C2H4与HCl发生加成反应,均可得到C2H5Cl | |
| D. | 用溴水一种试剂就可将苯、CCl4、乙酸、乙醇区别 |
 取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( )
取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( )| A. | a电极反应式是4OH--4e-═O2↑+2H2O | B. | b电极是阴极 | ||
| C. | 电解过程中水是氧化剂 | D. | b电极附近溶液的pH变大 |
 ?
? △H=-4.2kJ/mol.
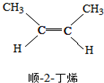
△H=-4.2kJ/mol.| A. | 顺-2-丁烯比反-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热比反-2-丁烯大 | |
| C. | 降温有利于平衡向生成顺-2-丁烯反应方向移动 | |
| D. | 反-2-丁烯和顺-2-丁烯具有相同的熔沸点 |
| A. | Na2O2中阴、阳离子的个数比为1:1 | |
| B. | Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等 | |
| C. | Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等 | |
| D. | Na2O2中氧的化合价为-2 |
 某同学通过查阅资料得知,铝热反应所得到的熔融物应该是铁铝合金.
某同学通过查阅资料得知,铝热反应所得到的熔融物应该是铁铝合金.