题目内容
14.某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-.分别取样:①加入浓氢氧化钠溶液,产生有刺激性气味的气体;②加氯水和淀粉无明显现象.为确定该溶液的组成,还需检验的离子是( )| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | NH4+ |
分析 ①加入浓氢氧化钠溶液,产生有刺激性气味的气体,应生成氨气,说明含有NH4+;②加氯水和淀粉无明显现象,说明不含I-,然后利用离子的共存及溶液呈电中性来分析还存在的离子和一定没有的离子,而对于不能确定的离子,则是还需检验的离子,以此解答该题.
解答 解:①加入浓氢氧化钠溶液,产生有刺激性气味的气体,应生成氨气,说明含有NH4+;②加氯水和淀粉无明显现象,说明不含I-,又溶液呈电中性,有阳离子必有阴离子,则溶液中有NH4+,必须同时存在阴离子,即SO42-必然存在,而Ba2+、SO42-能结合生成沉淀,则这两种离子不能共存,即一定不存在Ba2+;显然剩下的Na+是否存在无法判断,则需检验的离子是Na+.
故选A.
点评 本题考查离子的检验,为高频考点,侧重于学生的分析能力的考查,题目涉及确离子的共存、离子的检验、溶液呈电中性等知识,有助于训练学生解决问题时思维的严密性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.已知 298K 时,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,推测含 1molCH3COOH 的稀溶液与含 1mol NaOH 的稀溶液反应放出的热量( )
| A. | 大于 57.3 kJ | B. | 等于 57.3 kJ | C. | 小于 57.3 kJ | D. | 无法确定 |
2.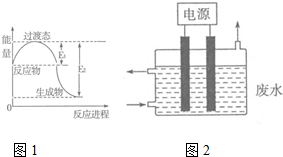 氮元素的化合物种类繁多,性质也各不相同.
氮元素的化合物种类繁多,性质也各不相同.
(1)图1为一定温度下1molNO2(g)和1molCO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图.已知E1=147.5kJ•mol-1,E2=376.2kJ•mol-1(E1、E2为反应的活化能).若在反应体系中加入催化剂,反应速率增大,则E1减小(填“增大”、“减小”或“不变”).该反应的热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-228.7KJ/mol.
(2)硝基苯甲酸乙酯在OH-存在的条件下发生水解反应:
O2NC6H4COOC2H5+OH-?O2NC6H4COOO-+C2H5OH
两种反应物的初始浓度均为0.050mol•L-1,某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如下表所示:
回答下列问题:①该反应在330s~530s的平均反应速率为$\frac{0.05×(73%-59%)}{200}$(只列算式,不做运算)
②为提高O2NC6H4COOC2H5的转化率,可以采取的措施有增加OH-的浓度、移去产物. (写1条即可)
(3)2015年8月12日天津港爆炸中有一定量的氰化物泄露,可用如图2所示装置除去含CN-、Cl-废水中的CN-,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,该反应的离子方程式为2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH-,,其中两个电极的材料分别为石墨和铁,则石墨作阳极,其电极反应式为Cl-+2OH--2e-═ClO-+H2O.
 氮元素的化合物种类繁多,性质也各不相同.
氮元素的化合物种类繁多,性质也各不相同.(1)图1为一定温度下1molNO2(g)和1molCO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图.已知E1=147.5kJ•mol-1,E2=376.2kJ•mol-1(E1、E2为反应的活化能).若在反应体系中加入催化剂,反应速率增大,则E1减小(填“增大”、“减小”或“不变”).该反应的热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-228.7KJ/mol.
(2)硝基苯甲酸乙酯在OH-存在的条件下发生水解反应:
O2NC6H4COOC2H5+OH-?O2NC6H4COOO-+C2H5OH
两种反应物的初始浓度均为0.050mol•L-1,某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如下表所示:
| t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
| α/% | 0 | 33 | 42 | 49 | 59 | 73 | 74 | 75 | 75 |
②为提高O2NC6H4COOC2H5的转化率,可以采取的措施有增加OH-的浓度、移去产物. (写1条即可)
(3)2015年8月12日天津港爆炸中有一定量的氰化物泄露,可用如图2所示装置除去含CN-、Cl-废水中的CN-,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,该反应的离子方程式为2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH-,,其中两个电极的材料分别为石墨和铁,则石墨作阳极,其电极反应式为Cl-+2OH--2e-═ClO-+H2O.
9.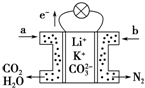 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )
 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )| A. | a为CH4,b为CO2 | |
| B. | CO32-向负极移动 | |
| C. | 此电池在常温时也能工作 | |
| D. | 正极电极反应式为O2+2H2O+4e-═4OH- |
6.某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:
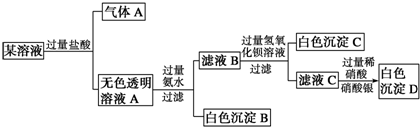
下列说法正确的是( )

下列说法正确的是( )
| A. | 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl-四种离子 | |
| B. | 原溶液中是否存在Na+无法判断 | |
| C. | 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+ | |
| D. | 生成沉淀B的离子方程式为:Al3++3OH-═Al(OH)3↓ |
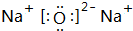 .
.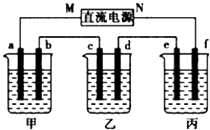 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g500%的NaOH溶液、足量的CuSO4溶液和l00g10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g500%的NaOH溶液、足量的CuSO4溶液和l00g10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:



 (1)写出明矾[KAl(SO4)2•12H2O]在水中的电离方程式KAl(SO4)2•12H2O=K++Al3++2SO42-+12H2O,明矾净水的原因是因为它与水反应产生的Al(OH)3胶体具有吸附性.
(1)写出明矾[KAl(SO4)2•12H2O]在水中的电离方程式KAl(SO4)2•12H2O=K++Al3++2SO42-+12H2O,明矾净水的原因是因为它与水反应产生的Al(OH)3胶体具有吸附性.