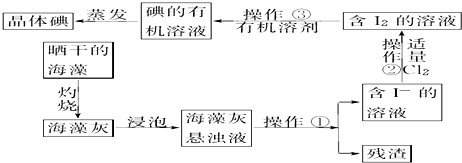
题目内容
16.为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气.下列关于Na2O2的叙述正确的是( )| A. | Na2O2中阴、阳离子的个数比为1:1 | |
| B. | Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等 | |
| C. | Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等 | |
| D. | Na2O2中氧的化合价为-2 |
分析 A.过氧化钠中阴离子为过氧根离子;
B.依据发生反应的方程式:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑解答;
C.过氧化钠与水、二氧化碳反应中,过氧化钠都是既做氧化剂又做还原剂,生成1mol氧气,转移电子数都是2mol;
D.依据化合物中,各元素化合价代数和为0解答.
解答 解:A.过氧化钠中阴离子为过氧根离子,所以Na2O2中阴、阳离子的个数比为1:2,故A错误;
B.由方程式可知,生成相同量的O2时消耗的水和二氧化碳的物质的量相同,但质量不同,故B错误;
C.由得失电子守恒知两者转移电子的物质的量相同,故C正确;
D.Na2O2中钠元素化合价为+1价,则氧的化合价为-1,故D错误;
故选:C.
点评 本题考查过氧化钠的性质,为高考高频考点,明确过氧化钠的结构及过氧化钠与水、二氧化碳发生的化学反应是解题关键,题目难度不大.

练习册系列答案
相关题目
6.某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:
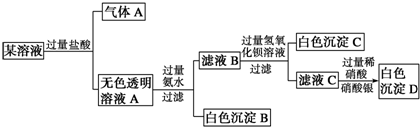
下列说法正确的是( )

下列说法正确的是( )
| A. | 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl-四种离子 | |
| B. | 原溶液中是否存在Na+无法判断 | |
| C. | 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+ | |
| D. | 生成沉淀B的离子方程式为:Al3++3OH-═Al(OH)3↓ |
7. 密闭容器中,反应2X(g)+Y(g)?2Z(g)△H=Q kJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的体积分数(φ)与反应时间(t)的关系如图所示.下列判断正确的是( )
密闭容器中,反应2X(g)+Y(g)?2Z(g)△H=Q kJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的体积分数(φ)与反应时间(t)的关系如图所示.下列判断正确的是( )
 密闭容器中,反应2X(g)+Y(g)?2Z(g)△H=Q kJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的体积分数(φ)与反应时间(t)的关系如图所示.下列判断正确的是( )
密闭容器中,反应2X(g)+Y(g)?2Z(g)△H=Q kJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的体积分数(φ)与反应时间(t)的关系如图所示.下列判断正确的是( )| A. | T1<T2,P1<P2,Q>0 | B. | T1>T2,P1>P2,Q>0 | C. | T1>T2,P1>P2,Q<0 | D. | T1<T2,P1<P2,Q<0 |
11.常温下,下列四种溶液:①pH=0的盐酸,②0.01mol•L-1的NaOH溶液,③pH=11的Na2CO3溶液中,由水电离生成的H+的物质的量浓度之比为( )
| A. | 1:100:1011 | B. | 1:12:11 | C. | 14:12:11 | D. | 14:2:1 |
8.用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol-CH3所含的电子数为10NA | |
| C. | 在人体内,180g葡萄糖完全被生理氧化所消耗的氧气的分子数为6NA | |
| D. | 0.5mol苯分子中含有1.5NA碳碳单键和1.5NA碳碳双键 |
5.科学家制造出由4个氧原子构成的氧分子,并用质谱仪探测后证实了它的存在.下列关于该氧分子的说法正确的是( )
| A. | 是氧元素的一种同位素 | |
| B. | 是氧元素的一种单质,分子内含有共价键 | |
| C. | 是一种新的氧化物 | |
| D. | 是臭氧的同分异构体 |
6.选择合适的试剂除去括号内的杂质,并写出对应的离子方程式.
| 物质(杂质) | 除杂试剂(化学式) | 离子方程式 |
| Na2CO3溶液(NaHCO3) | ||
| Fe(Al) | ||
| FeCl3溶液(FeCl2) |
 (1)写出明矾[KAl(SO4)2•12H2O]在水中的电离方程式KAl(SO4)2•12H2O=K++Al3++2SO42-+12H2O,明矾净水的原因是因为它与水反应产生的Al(OH)3胶体具有吸附性.
(1)写出明矾[KAl(SO4)2•12H2O]在水中的电离方程式KAl(SO4)2•12H2O=K++Al3++2SO42-+12H2O,明矾净水的原因是因为它与水反应产生的Al(OH)3胶体具有吸附性.