题目内容
18. 取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( )
取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( )| A. | a电极反应式是4OH--4e-═O2↑+2H2O | B. | b电极是阴极 | ||
| C. | 电解过程中水是氧化剂 | D. | b电极附近溶液的pH变大 |
分析 a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色,说明a先产生了Cl2,氯水呈酸性,且具有漂白性,使pH试纸外圈呈红色,内圈为白色,则a为阳极,b为阴极,a电极反应式为:2Cl--2e-═Cl2↑,b电极方程式为2H2O-4e-═H2↑+2OH-,所以b极附近的pH增大.
解答 解:a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色,说明a先产生了Cl2,氯水呈酸性,且具有漂白性,使pH试纸外圈呈红色,内圈为白色,Cl元素发生氧化反应,则a为阳极,电极反应式为:2Cl--2e-═Cl2↑,b为阴极,电极方程式为2H2O-4e-═H2↑+2OH-,所以b极附近的pH增大,电解过程中生成H2,H元素化合价降低,则水为氧化剂,
故选:A.
点评 本题考查电解原理、氯水的性质等,试题紧扣教材,趣味性强,有利于调动学生的学习兴趣和学习积极性,激发学生学习化学的求知欲,关键是对电解原理的理解掌握.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
9.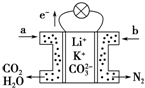 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )
 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )| A. | a为CH4,b为CO2 | |
| B. | CO32-向负极移动 | |
| C. | 此电池在常温时也能工作 | |
| D. | 正极电极反应式为O2+2H2O+4e-═4OH- |
6.某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:
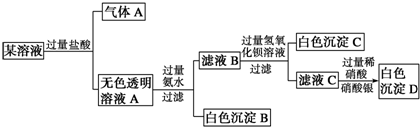
下列说法正确的是( )

下列说法正确的是( )
| A. | 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl-四种离子 | |
| B. | 原溶液中是否存在Na+无法判断 | |
| C. | 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+ | |
| D. | 生成沉淀B的离子方程式为:Al3++3OH-═Al(OH)3↓ |
10.下列关于Na2O2的叙述正确的是( )
| A. | Na2O2是淡黄色固体,久置于空气中变成Na2O | |
| B. | Na2O2与水的反应中,Na2O2只作氧化剂 | |
| C. | 用Na2O2漂白过的织物、麦杆等日久又渐渐变成黄色 | |
| D. | Na2O2放入饱和NaOH溶液中,放出大量的O2,并有白色固体析出 |
7. 密闭容器中,反应2X(g)+Y(g)?2Z(g)△H=Q kJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的体积分数(φ)与反应时间(t)的关系如图所示.下列判断正确的是( )
密闭容器中,反应2X(g)+Y(g)?2Z(g)△H=Q kJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的体积分数(φ)与反应时间(t)的关系如图所示.下列判断正确的是( )
 密闭容器中,反应2X(g)+Y(g)?2Z(g)△H=Q kJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的体积分数(φ)与反应时间(t)的关系如图所示.下列判断正确的是( )
密闭容器中,反应2X(g)+Y(g)?2Z(g)△H=Q kJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的体积分数(φ)与反应时间(t)的关系如图所示.下列判断正确的是( )| A. | T1<T2,P1<P2,Q>0 | B. | T1>T2,P1>P2,Q>0 | C. | T1>T2,P1>P2,Q<0 | D. | T1<T2,P1<P2,Q<0 |
8.用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol-CH3所含的电子数为10NA | |
| C. | 在人体内,180g葡萄糖完全被生理氧化所消耗的氧气的分子数为6NA | |
| D. | 0.5mol苯分子中含有1.5NA碳碳单键和1.5NA碳碳双键 |
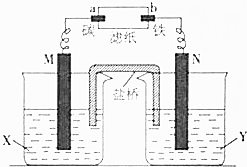 根据反应:Zn+CuSO4═Cu+ZnSO4设计原电池进行如图所示实验,滤纸上滴有酚酞和氯化钠溶液.实验进行一段时间后,在b电极附近出现红色.请回答下列问题:
根据反应:Zn+CuSO4═Cu+ZnSO4设计原电池进行如图所示实验,滤纸上滴有酚酞和氯化钠溶液.实验进行一段时间后,在b电极附近出现红色.请回答下列问题:


