题目内容
4.已知HCN、CN-在溶液中存在下列平衡,对应的平衡常数分别为K1和K2.①HCN?H++CN-△H1>0 K1
②CN-+H2O?HCN+OH-△H2>K2
常温下(K1=6.2×10-10),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述正确的是( )
| A. | K2≈1.6×10-3 | B. | 2c(Na+)=c(HCN)+c(CN-) | ||
| C. | 混合溶液的pH<7 | D. | 对混合溶液升温,K1增大、K2减小 |
分析 A、K1.K2=Kw,所以K2=$\frac{{K}_{w}}{{K}_{1}}$=$\frac{1{0}^{-14}}{6.2×1{0}^{-10}}$=1.6×10-5;
B、溶液中存在物料守恒,根据物料守恒判断;
C、K1.K2=Kw,所以K2=$\frac{{K}_{w}}{{K}_{1}}$=$\frac{1{0}^{-14}}{6.2×1{0}^{-10}}$=1.6×10-5>K1,所以HCN的电离程度小于CN?的水解程度;
D、升高温度,促进弱电解质电离、盐类水解;
解答 解:A、K1.K2=Kw,所以K2=$\frac{{K}_{w}}{{K}_{1}}$=$\frac{1{0}^{-14}}{6.2×1{0}^{-10}}$=1.6×10-5,故A错误;
B、将等体积、等物质的量浓度的HCN和NaCN溶液混合,溶液中存在物料守恒,根据物料守恒得2c(Na+)=c(HCN)+c(CN?),故B正确;
C、K1.K2=Kw,所以K2=$\frac{{K}_{w}}{{K}_{1}}$=$\frac{1{0}^{-14}}{6.2×1{0}^{-10}}$=1.6×10-5>K1,所以HCN的电离程度小于CN?的水解程度,所以混合溶液呈碱性,则pH>7,故C错误;
D、升高温度,促进弱电解质电离、盐类水解,则K1、K2都增大,故D错误;
故选:B.
点评 本题以盐类水解、弱电解质的电离为载体考查离子浓度大小比较,明确电离平衡常数、水解平衡常数、水的离子积关系是解本题关键,注意所有平衡常数只与温度有关,与溶液酸碱性、溶液浓度无关,题目难度不大.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
11.能用于除去甲烷中混有的乙烯的试剂是( )
| A. | 溴水 | B. | 酸性高锰酸钾溶液 | ||
| C. | 苛性钠溶液 | D. | 四氯化碳溶液 |
12.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
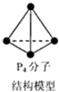

| A. | 常温常压下,16g 14CH4所含中子数目为8NA | |
| B. | 标准状况下,22.4 L CCl4所含分子数目为NA | |
| C. | 6.2g白磷(分子式为P4,分子结构如图所示)所含P-P键数目为0.3NA | |
| D. | 1mol含8个碳原子的某烃分子,最多形成8NA个碳碳单键 |
9.如表是Na、Mg、Si、S、Br五种元素的单质的沸点,其中b、e均是热和电的良导体.
(1)a呈深红棕色,a的元素在元素周期表中的位置为第四周期第VIIA族;
(2)写出d的元素原子的最外层电子排布式3s23p2;其元素原子核外中共有5种能量不同的电子;
(3)写出c的气态氢化物的水溶液与b的元素的最高价氧化物对应水化物反应的离子方程式H2S+2OH-=S 2-+H2O.
| 单质 | a | b | c | d | e |
| 沸点(℃) | 58.8 | 882.9 | 444.7 | 2 355 | 1 107 |
(2)写出d的元素原子的最外层电子排布式3s23p2;其元素原子核外中共有5种能量不同的电子;
(3)写出c的气态氢化物的水溶液与b的元素的最高价氧化物对应水化物反应的离子方程式H2S+2OH-=S 2-+H2O.
16.下列叙述中,不正确的是( )
| A. | 2H与3H互为同位素 | B. | 金刚石与石墨互为同素异形体 | ||
| C. | 3O2$\frac{\underline{\;放电\;}}{\;}$2O3是物理变化 | D. | 乙醇与二甲醚互为同分异构体 |
9.我国新修订的《环境保护法》已于2015年1月1日起施行.下列有关做法不正确的是( )
| A. | 用CO2合成聚碳酸酯等可降解塑料,以减少白色污染 | |
| B. | 减少生产、生活中产生的扬尘,以减少雾霾天气的形成 | |
| C. | 加强生活污水的脱氮、除磷处理,以遏制水体的富营养化 | |
| D. | 使用汽车尾气净化器.以减少二氧化碳的排放 |
16. 25℃时,向100mL 0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(设滴加过程中无气体产生).下列说法错误的是( )
25℃时,向100mL 0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(设滴加过程中无气体产生).下列说法错误的是( )
 25℃时,向100mL 0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(设滴加过程中无气体产生).下列说法错误的是( )
25℃时,向100mL 0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(设滴加过程中无气体产生).下列说法错误的是( )| A. | 未滴加NaOH溶液时溶液的pH小于相同条件下0.1mol•L-1 NaHSO4溶液的pH | |
| B. | pH为7时混合溶液中水的电离程度最大 | |
| C. | 当V(NaOH)=30mL时,c(NH3•H2O)+c(Na+)<2c(SO42-) | |
| D. | 滴加NaOH溶液的体积从30mL至40mL的过程中,$\frac{c(N{{H}_{4}}^{+})}{c({H}^{+})}$的值逐渐增大 |
13.常温下,800ml pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、NO2-、I-、SO42-中的四种,且各离子的物质的量浓度均为0.1mol•L-1,现取该溶液进行有关实验,已知HNO2是一种不稳定的弱酸,实验结果如图所示:
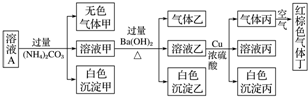
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子 | |
| B. | 实验最多消耗Cu 1.92g,生成气体丙在标准状态下体积为448mL | |
| C. | 沉淀乙一定有BaCO3,可能有BaSO4 | |
| D. | 为确定原溶液中是否有Na+、K+,可通过焰色反应来确定 |
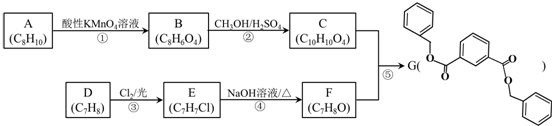
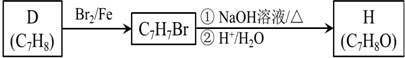
 .
.