题目内容
13.常温下,800ml pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、NO2-、I-、SO42-中的四种,且各离子的物质的量浓度均为0.1mol•L-1,现取该溶液进行有关实验,已知HNO2是一种不稳定的弱酸,实验结果如图所示: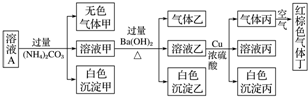
下列有关说法正确的是( )
| A. | 该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子 | |
| B. | 实验最多消耗Cu 1.92g,生成气体丙在标准状态下体积为448mL | |
| C. | 沉淀乙一定有BaCO3,可能有BaSO4 | |
| D. | 为确定原溶液中是否有Na+、K+,可通过焰色反应来确定 |
分析 由溶液pH=1可知溶液为酸性溶液,溶液中存在大量氢离子,可以排除CO32-、NO2-;
溶液A中加过量(NH4)2CO3,产生白色沉淀,白色沉淀只能为氢氧化铝,可以排除Fe2+、Fe3+,溶液含有一定有Al3+;
溶液乙加铜和浓硫酸能产生气体丙,丙在空气中变成红棕色,则丙为NO,原溶液中有NO3-,强酸性溶液中含有NO3-,则一定不存在具有还原性的离子:Fe2+、I-,最后根据电荷守恒得原溶液中含有NO3-、Al3+、SO42- Cl-五种离子.
解答 解:由溶液pH=1可知溶液为酸性溶液,氢离子浓度为0.1mol/L,溶液中一定不存在与氢离子反应的离子:CO32-、NO2-;
溶液A中加过量(NH4)2CO3,产生白色沉淀,可以排除Fe2+、Fe3+,原溶液中一定有Al3+;
溶液乙加铜和浓硫酸能产生NO,原溶液中有NO3-,强酸性溶液中有NO3-,则一定没有Fe2+、I-;
A.根据以上分析可知,溶液中存在0.1mol/L的氢离子、0.1mol/L的铝离子,溶液中阳离子带有的电荷为:0.4mol/L;而溶液中除了存在0.1mol/L的硝酸根离子外,还应该含有SO42-离子和Cl-,所以该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子,故A正确;
B.若果气体全部与硝酸反应,根据反应方程式3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O可知,消耗1.92g铜,生成一氧化氮气体的物质的量为:$\frac{1.92g}{64g/mol}$×$\frac{2}{3}$=0.02mol,标准状况下一氧化氮的体积为448mL,但是假如的浓硫酸,故铜也会与浓硫酸反应产生二氧化硫,产生的NO小于448mL,故B错误;
C.根据分析可知,溶液中含有硫酸根离子,所以沉淀乙中一定为碳酸钡和硫酸钡沉淀的化合物,故C错误;
D.根据上述分析,该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子,因为阴离子已经确定,根据电荷守恒没有钠离子和钾离子,故D错误;
故选A.
点评 本题考查了常见阴阳离子的检验、离子共存的判断,题目难度中等,注意掌握常见离子的性质及检验方法,判断硫酸根离子、氯离子时需要通过电荷守恒进行判断,试题培养了学生的分析、理解能力.

①HCN?H++CN-△H1>0 K1
②CN-+H2O?HCN+OH-△H2>K2
常温下(K1=6.2×10-10),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述正确的是( )
| A. | K2≈1.6×10-3 | B. | 2c(Na+)=c(HCN)+c(CN-) | ||
| C. | 混合溶液的pH<7 | D. | 对混合溶液升温,K1增大、K2减小 |
| A. | 该反应中Fe2+是还原剂,O2是还原产物 | |
| B. | 4 mol Na2O2在反应中共得到8NA个电子 | |
| C. | 每生成0.2 mol O2,则被Fe2+还原的氧化剂为0.4 mol | |
| D. | 反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀 |
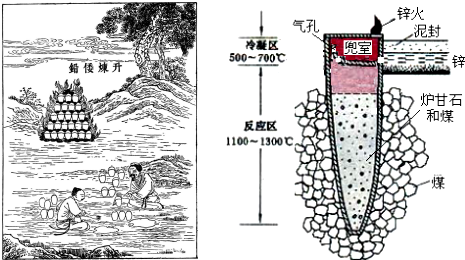
| A. | 升炼倭铅过程包含分解反应和氧化还原反应 | |
| B. | 冶炼时锌变为蒸气在兜室冷凝为固体 | |
| C. | “泥封”的目的是为了防止得到的锌被氧化 | |
| D. | “锌火”是锌蒸气和一氧化碳在空气的燃烧 |
| A. | 铅蓄电池在充电过程中,正、负极质量都增大 | |
| B. | 反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0 | |
| C. | NH3•H2O溶液加水稀释后,溶液中$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$的值减小 | |
| D. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 |
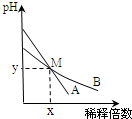 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )| A. | 稀释前,c(A)=10c(B) | |
| B. | 稀释前,A溶液中由水电离出的OH-的浓度大于10-7mol/L | |
| C. | 用醋酸中和A溶液至恰好完全反应时,溶液的pH为7 | |
| D. | 在M点,A、B两种碱溶液中阳离子的物质的量浓度相等 |

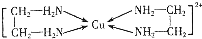 第四周期金属Cr、Fe、Cu在科学研究和工业生产中都有重要的用途.请回答下列问题:
第四周期金属Cr、Fe、Cu在科学研究和工业生产中都有重要的用途.请回答下列问题: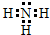 .
.