题目内容
16.下列叙述中,不正确的是( )| A. | 2H与3H互为同位素 | B. | 金刚石与石墨互为同素异形体 | ||
| C. | 3O2$\frac{\underline{\;放电\;}}{\;}$2O3是物理变化 | D. | 乙醇与二甲醚互为同分异构体 |
分析 A.质子数相同中子数不同的原子互称同位素,互为同位素原子具有以下特征:质子数相同、化学性质相同、在周期表中的位置相同;中子数不同、质量数不同、物理性质不同;研究对象为原子;
B.同素异形体是同种元素形成的不同单质;
C.同素异形体间的转化是化学变化;
D.具有相同分子式而结构不同的化合物互为同分异构体.
解答 解:A.同位素的特征是质子数相同中子数不同,则2H与3H互为同位素,故A正确;
B.金刚石与石墨互是单质,并且都是由碳元素形成,是同素异形体的关系,故B正确;
C.O2与O3是同种元素形成的不同单质,3O2$\frac{\underline{\;放电\;}}{\;}$2O3是化学变化,故C错误;
D.乙醇与二甲醚分子式相同,结构不同,互为同分异构体,故D正确;
故选:C.
点评 本题考查同位素、同素异形体、同分异构体,题目难度不大,注意把握概念是解决此类题的关键之所在.

练习册系列答案
相关题目
6.下列物质:①Cl2 ②HBr ③H2O ④H2,其中在一定条件下能与乙烯发生加成反应的是( )
| A. | ①② | B. | ③④ | C. | ①③④ | D. | 全部 |
7.(1)三种弱酸HA、H2B、HC,电离平衡常数的数值为:①1.8×10-5、②5.6×10-11、③4.9×10-10、④4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
①HA+HB-(少量)=A-+H2B,②H2B(少量)+C-=HB-+HC,③HA(少量)+C-=A-+HC..则三种酸对应的电离平衡常数分别为(请填空)
(2)常温下0.1mol/LCH3COOH溶液加水稀释过程,下列表达式数据一定变小的是A.
A.c(H+) B.c(H+)•c(OH-) C.$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$ D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(3)体积为10mLpH=2醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化分别为HX3.6、CH3COOH3.2,则HX电离平衡常数大于(填大于、等于或小于)醋酸平衡常数;理由是因为稀释相同倍数,HX的pH变化比CH3COOH大,即HX更易电离,所以HX电离平衡常数也大.
①HA+HB-(少量)=A-+H2B,②H2B(少量)+C-=HB-+HC,③HA(少量)+C-=A-+HC..则三种酸对应的电离平衡常数分别为(请填空)
| HA | H2B | HC | ||
| Ka | K${\;}_{{a}_{1}}$ | K${\;}_{{a}_{2}}$ | K${\;}_{{a}_{3}}$ | K${\;}_{{a}_{4}}$ |
| 数值 | ||||
A.c(H+) B.c(H+)•c(OH-) C.$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$ D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(3)体积为10mLpH=2醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化分别为HX3.6、CH3COOH3.2,则HX电离平衡常数大于(填大于、等于或小于)醋酸平衡常数;理由是因为稀释相同倍数,HX的pH变化比CH3COOH大,即HX更易电离,所以HX电离平衡常数也大.
4.已知HCN、CN-在溶液中存在下列平衡,对应的平衡常数分别为K1和K2.
①HCN?H++CN-△H1>0 K1
②CN-+H2O?HCN+OH-△H2>K2
常温下(K1=6.2×10-10),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述正确的是( )
①HCN?H++CN-△H1>0 K1
②CN-+H2O?HCN+OH-△H2>K2
常温下(K1=6.2×10-10),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述正确的是( )
| A. | K2≈1.6×10-3 | B. | 2c(Na+)=c(HCN)+c(CN-) | ||
| C. | 混合溶液的pH<7 | D. | 对混合溶液升温,K1增大、K2减小 |
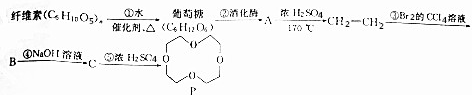
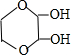 、
、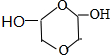 (任写一种)(不考虑立体异构)
(任写一种)(不考虑立体异构)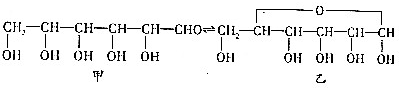
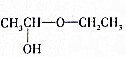 试写出由两种简单的有机物合成该烃基醚的化学方程式:CH3CHO+CH3CH2OH→
试写出由两种简单的有机物合成该烃基醚的化学方程式:CH3CHO+CH3CH2OH→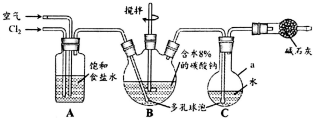 次氯酸(HClO)仅存在于溶液中,有很强的氧化性和漂白作用.某兴趣小组拟用Cl2O与潮湿Na2CO3反应制得Cl2O,再用水吸收Cl2O制备次氯酸溶液,并测定其浓度.
次氯酸(HClO)仅存在于溶液中,有很强的氧化性和漂白作用.某兴趣小组拟用Cl2O与潮湿Na2CO3反应制得Cl2O,再用水吸收Cl2O制备次氯酸溶液,并测定其浓度. .
.
 .
.