题目内容
12.设NA为阿伏加德罗常数的值,下列叙述正确的是( )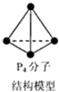
| A. | 常温常压下,16g 14CH4所含中子数目为8NA | |
| B. | 标准状况下,22.4 L CCl4所含分子数目为NA | |
| C. | 6.2g白磷(分子式为P4,分子结构如图所示)所含P-P键数目为0.3NA | |
| D. | 1mol含8个碳原子的某烃分子,最多形成8NA个碳碳单键 |
分析 A、14CH4的摩尔质量为18g/mol,根据质量计算出甲烷的物质的量和含有的中子数;
B.标准状况下四氯化碳为液体,无法计算四氯化碳的物质的量;
C.根据1molP4分子含有6molP-P键计算出6.2g白磷中含有的P-P键数目;
D.依据碳原子的最外层电子数是4,可以形成四个单键分析;
解答 解:A、16g14CH4的物质的量为$\frac{16}{18}$mol=$\frac{8}{9}$mol,含有中子的物质的量为:$\frac{8}{9}$mol,含有质子数为:$\frac{64}{9}$NA,故A错误;
B.在标况下,四氯化碳不是气体,无法计算22.4L四氯化碳的物质的量及分子数,故B错误;
C.6.2g白磷含有P4的物质的量为:$\frac{6.2g}{124g/mol}$=0.05mol,0.05molP4分子中含有P-P键的物质的量为:0.05mol×6=0.3mol,所含P-键数目为0.3NA,故C正确;
D.1mol含8个碳原子的某烃分子,碳原子形成最多化学键时,都以单键和原子形成,所以8个碳原子最多形成7个碳碳键,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,阿伏加德罗常数是高考的“热点”,它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容.要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
| W | X | |
| Y | Z |
| A. | W单质的化学性质很活泼 | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | X、Y、Z气态氢化物稳定性最弱的是Y | |
| D. | Z元素单质在化学反应中只表现氧化性 |
7.(1)三种弱酸HA、H2B、HC,电离平衡常数的数值为:①1.8×10-5、②5.6×10-11、③4.9×10-10、④4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
①HA+HB-(少量)=A-+H2B,②H2B(少量)+C-=HB-+HC,③HA(少量)+C-=A-+HC..则三种酸对应的电离平衡常数分别为(请填空)
(2)常温下0.1mol/LCH3COOH溶液加水稀释过程,下列表达式数据一定变小的是A.
A.c(H+) B.c(H+)•c(OH-) C.$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$ D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(3)体积为10mLpH=2醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化分别为HX3.6、CH3COOH3.2,则HX电离平衡常数大于(填大于、等于或小于)醋酸平衡常数;理由是因为稀释相同倍数,HX的pH变化比CH3COOH大,即HX更易电离,所以HX电离平衡常数也大.
①HA+HB-(少量)=A-+H2B,②H2B(少量)+C-=HB-+HC,③HA(少量)+C-=A-+HC..则三种酸对应的电离平衡常数分别为(请填空)
| HA | H2B | HC | ||
| Ka | K${\;}_{{a}_{1}}$ | K${\;}_{{a}_{2}}$ | K${\;}_{{a}_{3}}$ | K${\;}_{{a}_{4}}$ |
| 数值 | ||||
A.c(H+) B.c(H+)•c(OH-) C.$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$ D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(3)体积为10mLpH=2醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化分别为HX3.6、CH3COOH3.2,则HX电离平衡常数大于(填大于、等于或小于)醋酸平衡常数;理由是因为稀释相同倍数,HX的pH变化比CH3COOH大,即HX更易电离,所以HX电离平衡常数也大.
17.基准物质邻苯二甲酸氢钾(KHC8H4O4)可用于标定( )
| A. | 酸 | B. | 碱 | C. | 还原剂 | D. | 氧化剂 |
4.已知HCN、CN-在溶液中存在下列平衡,对应的平衡常数分别为K1和K2.
①HCN?H++CN-△H1>0 K1
②CN-+H2O?HCN+OH-△H2>K2
常温下(K1=6.2×10-10),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述正确的是( )
①HCN?H++CN-△H1>0 K1
②CN-+H2O?HCN+OH-△H2>K2
常温下(K1=6.2×10-10),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述正确的是( )
| A. | K2≈1.6×10-3 | B. | 2c(Na+)=c(HCN)+c(CN-) | ||
| C. | 混合溶液的pH<7 | D. | 对混合溶液升温,K1增大、K2减小 |
5.据《天工开物》记载,我国古代以炉甘石(主要成分是ZnCO3)来升炼倭铅(即锌),其原理如图.已知锌的熔点420℃、沸点906℃.则下列说法不正确的是( )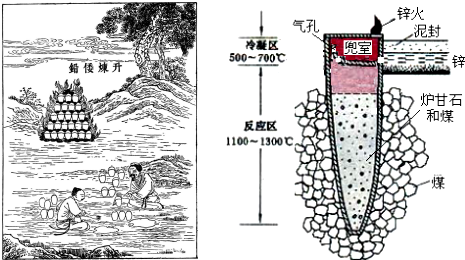

| A. | 升炼倭铅过程包含分解反应和氧化还原反应 | |
| B. | 冶炼时锌变为蒸气在兜室冷凝为固体 | |
| C. | “泥封”的目的是为了防止得到的锌被氧化 | |
| D. | “锌火”是锌蒸气和一氧化碳在空气的燃烧 |
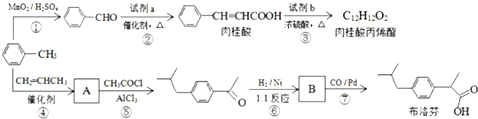
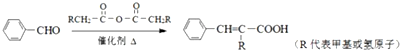
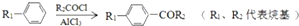
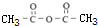 ;
;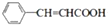 +CH2=CHCH2OH$→_{△}^{浓硫酸}$
+CH2=CHCH2OH$→_{△}^{浓硫酸}$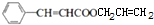 +H2O;
+H2O; ;
;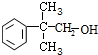 .
.
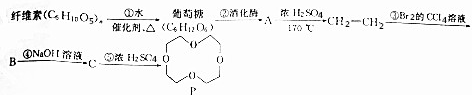
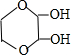 、
、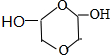 (任写一种)(不考虑立体异构)
(任写一种)(不考虑立体异构)