题目内容
5.香柠檬酚具有抗氧化功能,它的结构如图,下列说法正确的是( )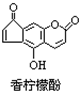
| A. | 它的分子式为C13H9O4 | |
| B. | 它与H2发生加成反应,1mol最多可消耗7mol H2 | |
| C. | 它与溴水发生反应,1mol最多消耗3mol Br2 | |
| D. | 它与NaOH溶液反应,1mol最多消耗2molNaOH |
分析 由结构可知分子式,分子中含酚-OH、碳碳双键、-COOC-、C=O,结合酚、烯烃、酯、酮的性质来解答.
解答 解:A.由结构可知它的分子式为C12H6O4,故A错误;
B.苯环、双键、酮基均与氢气发生加成反应,则它与H2发生加成反应,1mol最多可消耗6mol H2,故B错误;
C.酚-OH的对位、碳碳双键与溴水反应,它与溴水发生反应,1mol最多消耗3mol Br2,故C正确;
D.酚-OH、-COOC-及水解生成的酚-OH与NaOH反应,则它与NaOH溶液反应,1mol最多消耗3molNaOH,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意烯烃、酚、酯等常见有机物的性质,题目难度不大.

练习册系列答案
相关题目
13.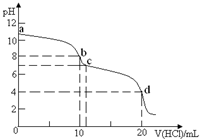 室温下,用0.1mol•L-1HCl溶液滴定10mL0.1mol•L-1K2CO3溶液,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.1mol•L-1HCl溶液滴定10mL0.1mol•L-1K2CO3溶液,滴定曲线如图所示.下列说法正确的是( )
 室温下,用0.1mol•L-1HCl溶液滴定10mL0.1mol•L-1K2CO3溶液,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.1mol•L-1HCl溶液滴定10mL0.1mol•L-1K2CO3溶液,滴定曲线如图所示.下列说法正确的是( )| A. | a点时:c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | b点时:c(K+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| C. | d点时,溶液中存在电离平衡:H2CO3?2H++CO32- | |
| D. | 由水电离产生的c(H+)大小顺序为:b<c<d |
13. 消除大气污染有多种方法.
消除大气污染有多种方法.
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+2NO2(g)═N2 (g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l)△H=-1248kJ•mol-1.
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理.已知含SO2的废气通入含Fe2+、Fe3+的溶液时,首先是Fe3+被还原成Fe2+,接着Fe2+再被氧化成Fe3+.后一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O.
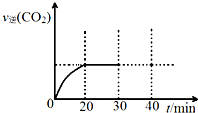
(3)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2 (g).某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
①10min~20min以v(CO2) 表示的平均反 应速率为0.009mol•L-1•min-1.
②根据表中数据,计算T1℃时该反应的平衡常数K=0.56(保留两位小数).
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”、“不变”或“减小”).
④请在图中画出30min至40min的变化曲线.
 消除大气污染有多种方法.
消除大气污染有多种方法.(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+2NO2(g)═N2 (g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l)△H=-1248kJ•mol-1.
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理.已知含SO2的废气通入含Fe2+、Fe3+的溶液时,首先是Fe3+被还原成Fe2+,接着Fe2+再被氧化成Fe3+.后一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O.
(3)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2 (g).某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
②根据表中数据,计算T1℃时该反应的平衡常数K=0.56(保留两位小数).
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”、“不变”或“减小”).
④请在图中画出30min至40min的变化曲线.
20.下列说法正确的是( )
| A. | 离子化合物中一定含有金属阳离子 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | 在酸碱盐中,碱与盐一定属于离子化合物 | |
| D. | 离子化合物中一定存在离子键 |
10.下列表示物质结构的化学用语正确的是( )
| A. | 镁离子的电子式:Mg2+ | B. | HF的电子式:H:F | ||
| C. | Cl-离子的结构示意图: | D. | NH4Cl的电子式: |
14.下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | 足球烯(C60)在苯中的溶解度比在乙醇中的溶解度大 | C60易溶于非极性溶剂苯而难溶于乙醇,符合相似相溶原理 |
| B | Fe3+可用SCN-检验 | 生成了Fe(SCN)3红色沉淀 |
| C | Cu(OH)2可溶于氨水 | 可生成深蓝色溶液[Cu(H2O)4]SO4 |
| D | HF的沸点高于HCl | HF的键长比HCl短 |
| A. | A | B. | B | C. | C | D. | D |
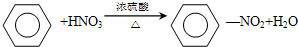 ,属于取代反应;
,属于取代反应; ,属于加成反应;
,属于加成反应; +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr,属于取代反应;
+HBr,属于取代反应;