题目内容
14.某有机物由碳、氢、氧三种元素组成,它们的质量比是6:1:8,在同温同压下,有机物蒸气对氢气的相对密度是30.在这有机物中加入金属钠,有氢气生成.试写出这有机物的同系物中最简单物质的结构简式和名称.分析 碳、氢、氧三种元素组成,它们的质量比是6:1:8,则原子个数比为$\frac{6}{12}$:$\frac{1}{1}$:$\frac{8}{16}$=1:2:1,设有机物为(CH2O)n,同温同压下,有机物蒸气对氢气的相对密度是30,则M=2×30=60,可知n=$\frac{60}{(12+1×2+16)}$=2,即有机物分子式为C2H4O2,结合这有机物中加入金属钠,有氢气生成,含-COOH,以此来解答.
解答 解:碳、氢、氧三种元素组成,它们的质量比是6:1:8,则原子个数比为$\frac{6}{12}$:$\frac{1}{1}$:$\frac{8}{16}$=1:2:1,设有机物为(CH2O)n,同温同压下,有机物蒸气对氢气的相对密度是30,则M=2×30=60,可知n=$\frac{60}{(12+1×2+16)}$=2,即有机物分子式为C2H4O2,结合这有机物中加入金属钠,有氢气生成,含-COOH,有机物结构简式为CH3COOH,这有机物的同系物中最简单物质的结构简式为HCOOH,名称为甲酸,
答:这有机物的同系物中最简单物质的结构简式为HCOOH,名称为甲酸.
点评 本题考查有机物分子式的计算,为高频考点,把握最简式、分子式、结构简式的计算确定方法为解答的关键,侧重分析与应用能力的考查,注意羧酸的通式及官能团,题目难度不大.

练习册系列答案
 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
2.某芳香烃的分子式为C9H10且分子中除苯环外不含其他环状结构,该芳香烃共有(不考虑立体异构)( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
9.鉴别乙醛溶液和乙醇溶液,使用的试剂是( )
| A. | 金属钠 | B. | 浓硫酸 | C. | 银氨溶液 | D. | 氢氧化钠 |
1.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu,Zn+H2SO4=ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4 与Zn反应产生的 Cu 与Zn形成铜锌原电池,加快了氢气产生的速率;
(3)实验室中现有Na2SO4、MgSO4、AgNO3、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是AgNO3;
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度;适当增加硫酸的浓度、增加锌粒的表面积等 (任答一种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10.
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu,Zn+H2SO4=ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4 与Zn反应产生的 Cu 与Zn形成铜锌原电池,加快了氢气产生的速率;
(3)实验室中现有Na2SO4、MgSO4、AgNO3、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是AgNO3;
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度;适当增加硫酸的浓度、增加锌粒的表面积等 (任答一种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | 30 | 30 | 30 | 30 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | 20 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
8.H2O2是一种常用绿色氧化剂,在化学研究中应用广泛.
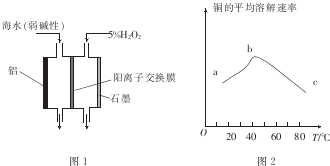
(1)常温下,用CO、O2和水在三苯基膦钯的催化下即可制得H2O2.相对于电解氢氧化钠溶液制H2O2,该方法具有的优点是安全、能耗低.
(2)图1是铝/过氧化氢电池结构示意图.铝电极为负极(填“正极”或“负极”),石墨电极的电极反应式为H2O2+2e-=2OH-
(3)印刷电路板中的金属铜可用10%的H2O2溶液和3.0mol.L-l的H2S04溶液处理,其他条件相同时,测得铜的平均溶解速率与温度的关系如图2所示.其中bc段曲线变化的主要原因是随着温度的升高,双氧水的分解速率加快
(4)为研究硫酸铁的量对过氧化氢分解速率的影响,某同学设计了如下一系列的实验.将表中所给的溶液分别加入A、B、C、D 4个反应瓶中,收集产生的气体,记录数据.
①记录的数据为收集相同体积气体所需的时间(或相同时间内收集气体的体积).
②上表中V3=15.2.

(1)常温下,用CO、O2和水在三苯基膦钯的催化下即可制得H2O2.相对于电解氢氧化钠溶液制H2O2,该方法具有的优点是安全、能耗低.
(2)图1是铝/过氧化氢电池结构示意图.铝电极为负极(填“正极”或“负极”),石墨电极的电极反应式为H2O2+2e-=2OH-
(3)印刷电路板中的金属铜可用10%的H2O2溶液和3.0mol.L-l的H2S04溶液处理,其他条件相同时,测得铜的平均溶解速率与温度的关系如图2所示.其中bc段曲线变化的主要原因是随着温度的升高,双氧水的分解速率加快
(4)为研究硫酸铁的量对过氧化氢分解速率的影响,某同学设计了如下一系列的实验.将表中所给的溶液分别加入A、B、C、D 4个反应瓶中,收集产生的气体,记录数据.
| 实验 体积/mL 液体 | A | B | C | D |
| 0.4mol.L-1Fe2(SO4)3溶液 | 0 | 1.8 | 2.0 | V1 |
| 30%H2O2溶液 | 20.0 | 20.0 | 20.0 | 20.0 |
| HO2 | V2 | V3 | 15.0 | 13.8 |
②上表中V3=15.2.
5.香柠檬酚具有抗氧化功能,它的结构如图,下列说法正确的是( )
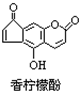

| A. | 它的分子式为C13H9O4 | |
| B. | 它与H2发生加成反应,1mol最多可消耗7mol H2 | |
| C. | 它与溴水发生反应,1mol最多消耗3mol Br2 | |
| D. | 它与NaOH溶液反应,1mol最多消耗2molNaOH |
6.铝与100mL稀硫酸的反应中,已知30s末共收集到标况下氢气336mL,若不考虑反应过程中溶液体积的变化,则30s内生成硫酸铝的平均反应速率是( )
| A. | 0.1 mol/(L•min) | B. | 3.6 mol/(L•min) | C. | 1.2 mol/(L•min) | D. | 0.017mol/(L•min) |