题目内容
15.某实验小组同学对电化学原理进行了一系列探究活动.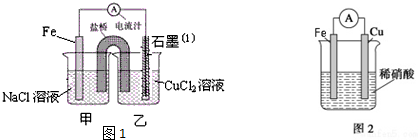
(1)图1为某实验小组依据氧化还原反应:Fe+Cu2+=Fe2++Cu(用离子方程式表示)设计的原电池装置,写出负极的电极反应式Fe-2e-=Fe2+.
(2)盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是B
A.盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用饱和KCl琼脂溶液
B.理论上1molFe溶解,盐桥中将有2molCl-进入左池,2molK+进入右池
C.此过程中Cu2+得电子,发生氧化反应
D.电子从铁电极通过导线到石墨电极,又通过盐桥到转移到左烧杯中
(3)反应前,两电极的质量相等,一段时间后,两电极质量相差18g,导线中通过0.3mol电子.
(4)用吸管吸出铁片附近溶液少许于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式Cl2+2Fe2+=2Cl-+2Fe3+,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:溶液中的+3价铁被氧化为更高的价态.”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式2Fe3++3Cl2+8H2O=2FeO42-+6Cl-+16H+.
(5)若铁和铜构成图2电池,发现铜电极上产生大量气泡,遇空气呈红棕色.写出正极电极反应式:4H++NO3-+3e-=NO↑+2H2O.
分析 (1)根据自发氧化还原反应知识,总的电极反应Fe+Cu2+=Fe2++Cu;负极发生氧化反应,电极反应式为Fe-2e-=Fe2+;
(2)A、盐桥中不是都可以用饱和KCl琼脂溶液,要考虑能否与电解质溶液反应;
B、1molFe反应,转移2mol电子;
C、Cu2+得电子发生还原反应;
D、盐桥中是离子移动,无电子通过;
(3)总反应式为Fe+Cu2+═Fe2++Cu,一段时间后,两电极质量相差12g,
则 Fe+Cu2+═Fe2++Cu 两极质量差△m 转移电子
56g 64g 56g+64g=120g 2mol
18g n
解得:n=0.3mol;
(4)新制氯水中的氯气氧化亚铁离子,生成铁离子;铁离子被氯气氧化为FeO42-,其反应的离子方程式为:2Fe3++3Cl2+8H2O=2FeO42-+6Cl-+16H+;
(5)正极上是硝酸根离子得电子生成NO,结合电荷守恒和原子守恒书写电极反应式.
解答 解:(1)根据自发氧化还原反应知识,总的电极反应Fe+Cu2+=Fe2++Cu;负极发生氧化反应,电极反应式为Fe-2e-=Fe2+,故答案为:Fe+Cu2+=Fe2++Cu;Fe-2e-=Fe2+;
(2)A、盐桥中不是都可以用饱和KCl琼脂溶液,若电解质溶液为硝酸银溶液时,会生成沉淀,故A错误;
B、1molFe反应,转移2mol电子,所以盐桥中将有2molCl-进入左池,2molK+进入右池,故B正确;
C、Cu2+得电子发生还原反应,故C错误;
D、盐桥中是离子移动,无电子通过,故D错误;故选:B;
(3)总反应式为Fe+Cu2+═Fe2++Cu,一段时间后,两电极质量相差12g,
则 Fe+Cu2+═Fe2++Cu 两极质量差△m 转移电子
56g 64g 56g+64g=120g 2mol
18g n
解得:n=0.3mol,故答案为:0.3mol;
(4)新制氯水中的氯气氧化亚铁离子,生成铁离子,其反应的离子方程式为:Cl2+2Fe2+=2Cl-+2Fe3+;铁离子被氯气氧化为FeO42-,其反应的离子方程式为:2Fe3++3Cl2+8H2O=2FeO42-+6Cl-+16H+,故答案为:Cl2+2Fe2+=2Cl-+2Fe3+;2Fe3++3Cl2+8H2O=2FeO42-+6Cl-+16H+;
(5)正极上是硝酸根离子得电子生成NO,有氢离子参与反应,电极反应式为:4H++NO3-+3e-=NO↑+2H2O,故答案为:4H++NO3-+3e-=NO↑+2H2O.
点评 本题考查了原电池原理、盐桥原理、电极反应式书写等,题目难度较大,注意把握电极反应方程式的书写和电子守恒在计算中的应用为解答该题的关键.

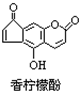
| A. | 它的分子式为C13H9O4 | |
| B. | 它与H2发生加成反应,1mol最多可消耗7mol H2 | |
| C. | 它与溴水发生反应,1mol最多消耗3mol Br2 | |
| D. | 它与NaOH溶液反应,1mol最多消耗2molNaOH |
| A. | 0.1 mol/(L•min) | B. | 3.6 mol/(L•min) | C. | 1.2 mol/(L•min) | D. | 0.017mol/(L•min) |
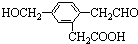 ,它在一定条件下可能发生的反应有( )
,它在一定条件下可能发生的反应有( )①加成 ②水解 ③取代 ④氧化 ⑤还原 ⑥消去.
| A. | ②③④ | B. | ①③⑤⑥ | C. | ①③④⑤ | D. | ①③④⑤⑥ |
| A. | 若原子半径X>Y,则气态氢化物稳定性:HmX<HnY | |
| B. | X、Y一定不是同周期元素 | |
| C. | 由mXa-与nYb-得m+a=n-b | |
| D. | Xa-的还原性一定强于Yb- |
| A. | 1.0L1.0mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 常温下,0.1mol碳酸钠晶体中含有CO32-的个数为0.1NA | |
| C. | 标准状况下,11.2L18O2中所含中子数为8NA | |
| D. | 25℃时,1LpH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
| A. | 乙烯使酸性高锰酸钾溶液及溴的四氯化碳溶液褪色原理相同 | |
| B. | 工业利用乙烯水化法制乙醇,是发生了取代反应 | |
| C. | 水果运输中为延长果实的成熟期,常在车厢里放置浸泡过高锰酸钾溶液的硅藻土 | |
| D. | 乙烯在空气中燃烧,发生火焰明亮并带有浓烟的火焰 |
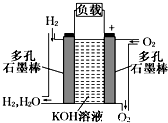 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: 已知甲酸(HCOOH)是羧酸中组成最简单的酸,它具有羧酸的性质,在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有能发生酯化反应的性质,装置如图所示.
已知甲酸(HCOOH)是羧酸中组成最简单的酸,它具有羧酸的性质,在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有能发生酯化反应的性质,装置如图所示.