题目内容
13.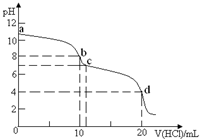 室温下,用0.1mol•L-1HCl溶液滴定10mL0.1mol•L-1K2CO3溶液,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.1mol•L-1HCl溶液滴定10mL0.1mol•L-1K2CO3溶液,滴定曲线如图所示.下列说法正确的是( )| A. | a点时:c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | b点时:c(K+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| C. | d点时,溶液中存在电离平衡:H2CO3?2H++CO32- | |
| D. | 由水电离产生的c(H+)大小顺序为:b<c<d |
分析 A.a点为碳酸钾溶液,由于氢氧根离子来自水的电离和碳酸根离子的水解,则c(OH-)>c(HCO3-);
B.b点加入10mLHCl溶液,二者恰好反应生成碳酸氢钾和氯化钾,根据溶液中的物料守恒判断;
C.多元弱酸分步电离;
D.碳酸钾促进了水的电离、酸溶液抑制了水的电离,据此进行判断.
解答 解:A.碳酸根离子部分水解,溶液显示碱性,则:c(K+)>c(CO32-),由于氢氧根离子来自水的电离和碳酸根离子的水解,则c(OH-)>c(HCO3-),溶液中离子浓度大小为:c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故A错误;
B.b点加入10mLHCl溶液,二者恰好反应生成碳酸氢钾和氯化钾,钾离子的浓度是含碳微粒总浓度的二倍,根据溶液中的物料守恒可得:c(K+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故B正确;
C.多元弱酸分步电离,则d点时,溶液中存在电离平衡:H2CO3?H++HCO3-,HCO3-?H++CO32-,故C错误;
D.碳酸钾溶液中的氢氧根离子是水电离的,溶液pH越大,水的电离程度越大,则abc三点水的电离程度大小为:a>b>c,d点盐酸过量,溶液显示酸性,氢离子抑制了水的电离,则d点水的电离程度最小,则水的电离程度大小为:b>c>d,故D错误.
故选B.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断,题目难度中等,明确反应后溶质的组成为解答关键,注意掌握酸碱混合的定性判断方法,能够根据盐的水解原理、电荷守恒、物料守恒等知识判断离子浓度大小.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式为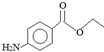 .下列关于苯佐卡因的叙述正确的是( )
.下列关于苯佐卡因的叙述正确的是( )
 .下列关于苯佐卡因的叙述正确的是( )
.下列关于苯佐卡因的叙述正确的是( )| A. | 分子中含有3种官能团 | |
| B. | 1 mol该化合物最多与4 mol氢气发生加成反应 | |
| C. | 苯环上有2个取代基,且含有硝基的同分异构体有15种 | |
| D. | 分子式为C9H10NO2 |
1.某原电池的总反应的离子方程式为:Zn+Cu2+═Zn2++Cu,则该原电池的正确组成可以是下列的( )
| A. | 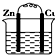 CuSO4溶液 | B. | 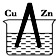 ZnSO4溶液 | ||
| C. | 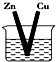 酒精 | D. | 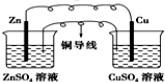 |
8.下列说法正确的是( )
| A. | 同主族元素从上到下,其氢化物的稳定性逐渐增强 | |
| B. | 同周期元素(0族除外) 从左到右,原子半径逐渐减小 | |
| C. | 将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀 | |
| D. | Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 |
18. X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )
 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )| A. | 五种元素中,原子半径最大的是W | |
| B. | Y与Z形成的化合物都可以和盐酸反应 | |
| C. | 简单阴离子的还原性:Y>W | |
| D. | Z与Q形成的化合物水溶液一定显酸性 |
2.某芳香烃的分子式为C9H10且分子中除苯环外不含其他环状结构,该芳香烃共有(不考虑立体异构)( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
5.香柠檬酚具有抗氧化功能,它的结构如图,下列说法正确的是( )
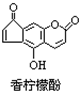

| A. | 它的分子式为C13H9O4 | |
| B. | 它与H2发生加成反应,1mol最多可消耗7mol H2 | |
| C. | 它与溴水发生反应,1mol最多消耗3mol Br2 | |
| D. | 它与NaOH溶液反应,1mol最多消耗2molNaOH |