题目内容
8.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 标准状况下,44.8L乙醇中含有的分子数目为0.2NA | |
| B. | 常温常压下,6.4gSO2中含有的氧原子数目为0.2NA | |
| C. | 1L0.1mol•L-1K2CO3溶液中含有的钾离子数目为0.1NA | |
| D. | 100mL1.0mol•L-1FeCl3溶液与足量铜反应,转移的电子数目为0.2NA |
分析 A.标况下,乙醇是液体,不能用气体摩尔体积计算其物质的量;
B.气体质量、分子数和原子数与温度压强无关,6.4gSO2中n(SO2)=$\frac{6.4g}{64g/mol}$=0.1mol,二氧化硫分子数为0.1NA,每个二氧化硫分子中含有2个O原子;
C.K2CO3溶液中c(K+)是c(K2CO3)的2倍,该溶液中n(K+)=0.1mol/L×2×1L=0.4mol,根据N=nNA计算钾离子个数;
D.n(FeCl3)=1.0mol/L×0.1L=0.1mol,发生的离子反应方程式为Cu+2Fe3+=2Fe2++Cu2+,1mol氯化铁参加反应有1mol电子转移,据此计算转移电子数.
解答 解:A.标况下,乙醇是液体,不能用气体摩尔体积计算其物质的量,所以无法计算乙醇物质的量,导致无法计算乙醇分子数,故A错误;
B.气体质量、分子数和原子数与温度压强无关,6.4gSO2中n(SO2)=$\frac{6.4g}{64g/mol}$=0.1mol,二氧化硫分子数为0.1NA,每个二氧化硫分子中含有2个O原子,所以O原子个数为0.2NA,故B正确;
C.K2CO3溶液中c(K+)是c(K2CO3)的2倍,该溶液中n(K+)=0.1mol/L×2×1L=0.4mol,钾离子个数N=nNA=0.4mol×NA/mol=0.4NA,故C错误;
D.n(FeCl3)=1.0mol/L×0.1L=0.1mol,发生的离子反应方程式为Cu+2Fe3+=2Fe2++Cu2+,1mol氯化铁参加反应有1mol电子转移,所以0.1mol氯化铁完全反应转移电子物质的量为0.1mol,转移电子数为0.1NA,故D错误;
故选B.
点评 本题以阿伏伽德罗常数为载体考查物质的量有关计算,为高频考点,明确物质的量公式中各个物理量关系、气体摩尔体积适用范围及适用条件是解本题关键,易错选项是AB,注意B中气体质量、分子数及原子数与温度压强无关,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案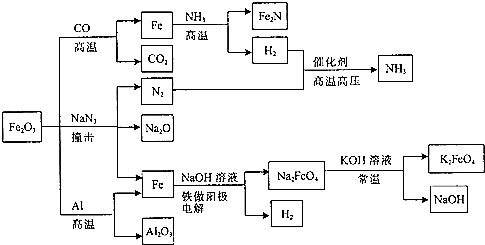
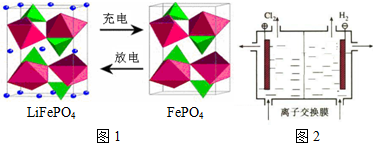
| A. | Fe2O3与Al的反应属于吸热反应 | |
| B. | Fe2O3与NaN3反应,每消耗1molFe2O3产生9molN2 | |
| C. | Fe2O3与CO的反应属于置换反应 | |
| D. | 常温下K2FeO4在水中的溶解度比Na2FeO4的大 |
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(2)反应①中的a大于 0(填“大于”、“小于”或“等于”).
(3)700℃时反应①达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有(填序号).
A.缩小反应器体积 B.通入CO2 C.升高温度到 900℃D.使用合适的催化剂
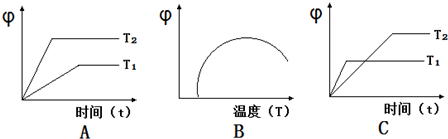
(4)如图图象符合反应①的是(填序号)(图中φ是混合物中CO的含量;T为温度).
(5)反应③2Fe(s)+O2(g)═2FeO(s)△H3=2(a+b)kJ•mol-1.
| A. | 常温下SO3是液体 | |
| B. | 标准状况下,1 mol SO3的体积约为22.4L | |
| C. | SO3与CaO反应生成CaSO3 | |
| D. | SO2遇空气即生成SO3 |
| A. |  | B. |  | C. |  | D. |  |
①适量的盐酸 ②适量的NaCl ③适量的醋酸 ④适量的CH3COONa.
| A. | ①② | B. | ③ | C. | ③④ | D. | ④ |
| A | B | C | D |
| NaAlO2溶液中逐滴滴加盐酸至过量 | AlCl3溶液中逐滴滴加氨水至过量 | 明矾[KAl(SO4)2•12H2O]溶液中逐滴滴加Ba(OH)2溶液至过量 | 澄清石灰水中缓慢通入CO2至过量 |
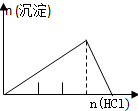 | 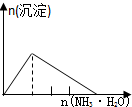 | 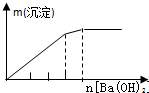 | 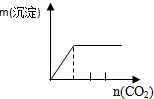 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |