题目内容
18.Fe2O3在工业上有重要的用途,可发生如图所示的一系列反应.下列说法正确的是( )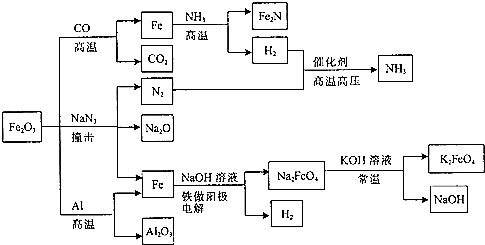
| A. | Fe2O3与Al的反应属于吸热反应 | |
| B. | Fe2O3与NaN3反应,每消耗1molFe2O3产生9molN2 | |
| C. | Fe2O3与CO的反应属于置换反应 | |
| D. | 常温下K2FeO4在水中的溶解度比Na2FeO4的大 |
分析 A.Fe2O3与Al的反应属于铝热反应,是放热反应;
B.Fe2O3与NaN3反应,生成N2、Na2O和Fe,结合氧化还原反应电子守恒计算每消耗1molFe2O3产生N2的物质的量;
C.单质和化合物反应生成另一种单质和另一种化合物的反应为置换反应;
D.加入KOH固体,可析出高铁酸钾,从沉淀平衡的角度分析;
解答 解:A.Fe2O3与Al的反应属于铝热反应,反应过程中放出大量的热,属于放热反应,故A错误;
B.Fe2O3与NaN3反应,生成N2、Na2O和Fe,Fe2O3~2Fe~6e-,NaN3~N2~2e-,Fe2O3~3N2~26e-,每消耗1molFe2O3产生3molN2 ,故B错误;
C.Fe2O3与CO的反应为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe,不符合置换反应概念,不属于置换反应,故C错误;
D.加入KOH固体,可析出高铁酸钾,说明高铁酸钾在该温度下的溶解度比高铁酸钠的溶解度小,故D正确;
故选D.
点评 本题考查氧化还原反应,题目难度中等,注意元素化合价的变化以及反应物和生成物的物质的量的关系,流程分析判断为解答该题的关键.

练习册系列答案
相关题目
8.化学与生活密切相关,下列表述正确的是( )
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 明矾常用于水体的净化、杀菌和消毒 | |
| C. | 热的纯碱溶液去污效果更好 | |
| D. | 84消毒液与洁厕灵混合后用于清洁洗手间的效果更好 |
13.在一些化学反应中,往往会涉及反应的先后顺序问题.下列实验中,离子反应的先后顺序判断正确的是( )
| A. | 含等物质的量的Al3+、NH4+的溶液中,逐滴加入NaOH溶液:Al3+、NH4+ | |
| B. | 含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| C. | 含等物质的量的Fe3+、Cu2+的溶液中,加入铁粉:Cu2+、Fe3+ | |
| D. | 含等物质的量的CH3COO-、ClO-溶液中,逐滴加入稀盐酸:CH3COO-、ClO- |
10.下列关于元素的叙述正确的是( )
| A. | 目前使用的元素周期表中,最长的周期含有36种元素 | |
| B. | 只有在原子中,质子数才与核外电子数相等 | |
| C. | 金属元素与非金属元素能形成共价化合物 | |
| D. | 非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8 |
7.火药是中国古代的四大发明之一,已知黑火药爆炸方程式为:S+2KNO3+3C═K2S+N2↑+3CO2↑,请问该反应中被硫氧化的碳和被硝酸钾氧化的碳的物质的量之比是( )
| A. | 1:3 | B. | 1:4 | C. | 1:5 | D. | 1:6 |
8.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,44.8L乙醇中含有的分子数目为0.2NA | |
| B. | 常温常压下,6.4gSO2中含有的氧原子数目为0.2NA | |
| C. | 1L0.1mol•L-1K2CO3溶液中含有的钾离子数目为0.1NA | |
| D. | 100mL1.0mol•L-1FeCl3溶液与足量铜反应,转移的电子数目为0.2NA |