题目内容
12.LiFePO4电池具有稳定性高、安全、对环境友好等优点.某电极的工作原理如图1所示,该电池电解质为能传导 Li+的固体材料.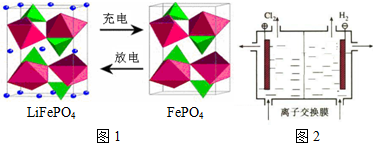
(1)放电时,该电极为正极,电极反应为FePO4+e-+Li+=LiFePO4
(2)充电时该电极连接外接电源的正极
(3)放电时,电池负极的质量减少(减少、增加、不变)
(4)LiOH可做制备锂离子电池电极的材料,利用如图2装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.阴极区电解液为LiOH溶液(填化学式),离子交换膜应使用阳(阳、阴)离子交换膜.
分析 放电时,该装置是原电池,Fe元素化合价由+3价变为+2价,得电子发生还原反应,所以该电极是正极,电极反应式为FePO4+e-+Li+=LiFePO4,
电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液,由图可知,右侧生成氢气,则氢离子放电,可知为阴极,制备LiOH,Li+由左侧经过阳离子交换膜向右侧电极移动.
解答 解:(1)放电时,该装置是原电池,Fe元素化合价由+3价变为+2价,得电子发生还原反应,所以该电极是正极,电极反应式为FePO4+e-+Li+=LiFePO4,
故答案为:正;FePO4+e-+Li+=LiFePO4;
(2)充电时LiFePO4生成FePO4,被氧化,应连接电源的正极,故答案为:正极;
(3)放电时,FePO4被还原而消耗,则电极质量减少,故答案为:减少;
(4)电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液,由图可知,右侧生成氢气,则氢离子放电,可知为阴极,制备LiOH,Li+由左侧经过阳离子交换膜向右侧电极移动,应为阳离子交换膜,
故答案为:LiOH;阳.
点评 本题考查了化学电源新型电池,为高频考点,侧重于学生的分析能力的考查,熟悉元素化合价是解本题关键,根据图片中得失电子判断正负极,再结合图片书写电极反应式,题目难度不大

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下列关于元素的叙述正确的是( )
| A. | 目前使用的元素周期表中,最长的周期含有36种元素 | |
| B. | 只有在原子中,质子数才与核外电子数相等 | |
| C. | 金属元素与非金属元素能形成共价化合物 | |
| D. | 非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8 |
8.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,44.8L乙醇中含有的分子数目为0.2NA | |
| B. | 常温常压下,6.4gSO2中含有的氧原子数目为0.2NA | |
| C. | 1L0.1mol•L-1K2CO3溶液中含有的钾离子数目为0.1NA | |
| D. | 100mL1.0mol•L-1FeCl3溶液与足量铜反应,转移的电子数目为0.2NA |
7.“2015.8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.已知部分弱酸的电离平衡常数如下表:
(1)根据价键规则,写出HCN的结构式是H-C≡N;
(2)下列能用于判断氮、碳两种元素非金属性强弱的是bc.(填序号)
a.气态氢化物沸点;b.最高价氧化物对应水化物酸性强弱;
c.Al2O3+N2+3C═2AlN+3CO;d.单质晶体类型;
(3)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是CN-+H2O?HCN+OH-;通过列式计算“c(CN-)与c(HCN)”的大小K=$\frac{c(HCN)c(O{H}^{-})}{c(C{N}^{-})}$=$\frac{Kw}{Ka(HCN)}$=$\frac{1{0}^{-14}}{5×1{0}^{-10}}$,$\frac{c(HCN)}{c(C{N}^{-})}$=$\frac{2×1{0}^{-5}}{1{0}^{-5}}$=2,c(CN-)<c(HCN)判断:c(CN-)<c(HCN)(填“>”、“<”或“=”)
(4)含CN-的污水危害很大.处理该污水时,可在催化剂TiO2作用下用NaClO将CN-氧化成CNO-.CNO-在酸性条件下继续被NaClO氧化生成N2与CO2.某环保部门用下图装置进行实验,以证明该处理方法的有效性并测定CN-被处理的百分率.

将浓缩后含CN-的废水与过量NaClO溶液的混合液(其中CN-浓度为0.05mol/L)200mL倒入甲中,塞上橡皮塞,一段时间后,打开活塞,使溶液全部放入乙中,关闭活塞.
①甲中反应的离子方程式为CN-+ClO-=CNO-+Cl-;乙中反应的离子方程式为2CNO-+3ClO-+2H+═N2+2CO2+3Cl-+H2O.
②乙中生成的气体除CO2、N2外还有HCl及副反应生成的Cl2等,上述实验是通过测定CO2的量来确定CN-的处理效果.丙中加入的除杂试剂是A(填标号).
(A)饱和食盐 (B)饱和NaHCO3溶液 (C)浓NaOH溶液 (D)浓硫酸
丁在实验中的作用是除去混合气体中Cl2防止对CO2测定量的影响.戊中盛有足量的石灰水,若实验后戊中共生成0.8g沉淀,则该实验中CN-被处理的百分率>80%(填“>”、“二”或“<”=).
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
(2)下列能用于判断氮、碳两种元素非金属性强弱的是bc.(填序号)
a.气态氢化物沸点;b.最高价氧化物对应水化物酸性强弱;
c.Al2O3+N2+3C═2AlN+3CO;d.单质晶体类型;
(3)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是CN-+H2O?HCN+OH-;通过列式计算“c(CN-)与c(HCN)”的大小K=$\frac{c(HCN)c(O{H}^{-})}{c(C{N}^{-})}$=$\frac{Kw}{Ka(HCN)}$=$\frac{1{0}^{-14}}{5×1{0}^{-10}}$,$\frac{c(HCN)}{c(C{N}^{-})}$=$\frac{2×1{0}^{-5}}{1{0}^{-5}}$=2,c(CN-)<c(HCN)判断:c(CN-)<c(HCN)(填“>”、“<”或“=”)
(4)含CN-的污水危害很大.处理该污水时,可在催化剂TiO2作用下用NaClO将CN-氧化成CNO-.CNO-在酸性条件下继续被NaClO氧化生成N2与CO2.某环保部门用下图装置进行实验,以证明该处理方法的有效性并测定CN-被处理的百分率.

将浓缩后含CN-的废水与过量NaClO溶液的混合液(其中CN-浓度为0.05mol/L)200mL倒入甲中,塞上橡皮塞,一段时间后,打开活塞,使溶液全部放入乙中,关闭活塞.
①甲中反应的离子方程式为CN-+ClO-=CNO-+Cl-;乙中反应的离子方程式为2CNO-+3ClO-+2H+═N2+2CO2+3Cl-+H2O.
②乙中生成的气体除CO2、N2外还有HCl及副反应生成的Cl2等,上述实验是通过测定CO2的量来确定CN-的处理效果.丙中加入的除杂试剂是A(填标号).
(A)饱和食盐 (B)饱和NaHCO3溶液 (C)浓NaOH溶液 (D)浓硫酸
丁在实验中的作用是除去混合气体中Cl2防止对CO2测定量的影响.戊中盛有足量的石灰水,若实验后戊中共生成0.8g沉淀,则该实验中CN-被处理的百分率>80%(填“>”、“二”或“<”=).
4.下列物质的转化在给定条件下不能实现的是( )
| A. | Ca(ClO)2(aq)$\stackrel{CO_{2}}{→}$HClO(aq)$\stackrel{光照}{→}$HCl(aq) | |
| B. | NaCl(饱和)$\stackrel{NH_{3}、CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | Al2O3$\stackrel{NaOH(aq)}{→}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| D. | NaAlO2(aq)$\stackrel{过量盐酸}{→}$AlCl3$\stackrel{电解}{→}$Al |
2.一定条件下,反应N2(g)+3H2(g)?2NH3(g)在10L的密闭容器中进行,测得2min内N2的物质的量由20mol减小到8mol,则2min内用NH3表示的反应速率为( )
| A. | 1.2mol/(L•min) | B. | 6.0mol/(L•min) | C. | 0.6mol/(L•min) | D. | 0.4mol/(L•min) |