题目内容
19.反应①Fe(s)+CO2(g)?FeO(s)+CO(g)△H1=akJ•mol-1,平衡常数为K;反应②CO(g)+$\frac{1}{2}$O2(g)?CO2(g)△H2=bkJ•mol-1.测得在不同温度下,K值如表:| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(2)反应①中的a大于 0(填“大于”、“小于”或“等于”).
(3)700℃时反应①达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有(填序号).
A.缩小反应器体积 B.通入CO2 C.升高温度到 900℃D.使用合适的催化剂
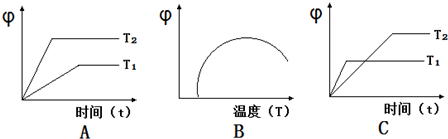
(4)如图图象符合反应①的是(填序号)(图中φ是混合物中CO的含量;T为温度).
(5)反应③2Fe(s)+O2(g)═2FeO(s)△H3=2(a+b)kJ•mol-1.
分析 (1)令平衡时CO的浓度为cmol/L,根据三段式用c表示出平衡时各成分的浓度,再根据平衡常数列方程计算;
(2)由表中数据可知,对于反应①,温度越高平衡常数越大,说明升高温度平衡向正反应移动,据此判断a值的符号;
(3)根据平衡移动原理进行分析解答;
(4)A、由图可知,升高温度,平衡向正反应移动,故图象表示正反应吸热反应,结合反应①的热效应判断;
B、由图可知,最高点到达平衡,温度升高,混合物中CO的含量降低,平衡向逆反应进行,故图象表示正反应为放热反应,结合反应①的热效应判断;
C、由图可知,温度T1先到达平衡,故温度T1>T2,温度T1到达平衡时,混合物中CO的含量降低,平衡向逆反应进行,故图象表示正反应为放热反应,结合反应①的热效应判断;
(5)根据盖斯定律,2×(①+②)可得2Fe(s)+O2(g)═2FeO(s),反应热也进行相应的运算得出△H3.
解答 解:(1)令平衡时CO的浓度为cmol/L,则:
Fe(s)+CO2(g)═FeO(s)+CO(g)
开始(mol/L):2 0
变化(mol/L):c c
平衡(mol/L):2-c c
则:$\frac{c}{2-c}$=1,解得:c=1,
故答案为:1mol/L;
(2)由表中数据可知,对于反应①,温度越高平衡常数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应进行,故a>0,
故答案为:大于;
(3)A.该反应前后气体的物质的量不变,缩小反应器体积,压强增大,平衡不移动,故A错误;
B.通入CO2 ,浓度增大,平衡向正反应移动,故B在;
C.该反应正反应是吸热反应,升高温度到900℃,平衡向正反应移动,故C在;
D.使用合适的催化剂,加快反应速率,平衡不移动,故D错误;
故答案为:BC;
(4)A、由图可知,升高温度,平衡向正反应移动,故图象表示正反应吸热反应,反应①正反应是吸热反应,图象与实际相符合,故A正确;
B、由图可知,最高点到达平衡,温度升高,混合物中CO的含量降低,平衡向逆反应进行,故图象表示正反应为放热反应,反应①正反应是吸热反应,图象与实际不相符,故B错误;
C、由图可知,温度T1先到达平衡,故温度T1>T2,温度T1到达平衡时,混合物中CO的含量降低,平衡向逆反应进行,故图象表示正反应为放热反应,反应①正反应是吸热反应,图象与实际不相符,故C错误;
故答案为:A;
(5)已知:①Fe(s)+CO2(g)═FeO(s)+CO(g)△H=a kJ•mol-1,
②CO(g)+1/2O2(g)═CO2(g)△H=b kJ•mol-1
由盖斯定律(①+②)×2得:2Fe(s)+O2(g)═2FeO(s),△H3=2(a kJ•mol-1+b kJ•mol-1)=2(a+b)kJ•mol-1,
故答案为:2(a+b)kJ•mol-1.
点评 本题考查化学平衡的计算,题目难度中等,综合性较大,涉及反应速率计算、平衡常数、化学平衡计算、影响反应速率与化学平衡移动的因素、盖斯定律与反应热的计算等知识,注意熟练掌握化学平衡及其影响因素,试题培养了学生的分析能力及化学计算能力.

| A. | 目前使用的元素周期表中,最长的周期含有36种元素 | |
| B. | 只有在原子中,质子数才与核外电子数相等 | |
| C. | 金属元素与非金属元素能形成共价化合物 | |
| D. | 非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8 |
| A. | 1:3 | B. | 1:4 | C. | 1:5 | D. | 1:6 |
①NaOH固体 ②硝酸钠溶液 ③H2O ④CH3COONa 固体 ⑤硫酸钾溶液.
| A. | ①③⑤ | B. | ③④⑤ | C. | ②③⑤ | D. | ②③④⑤ |
| A. | 标准状况下,44.8L乙醇中含有的分子数目为0.2NA | |
| B. | 常温常压下,6.4gSO2中含有的氧原子数目为0.2NA | |
| C. | 1L0.1mol•L-1K2CO3溶液中含有的钾离子数目为0.1NA | |
| D. | 100mL1.0mol•L-1FeCl3溶液与足量铜反应,转移的电子数目为0.2NA |