题目内容
9.列实验与对应示意图的关系正确的是( )| A | B | C | D |
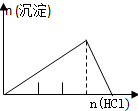
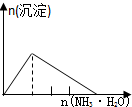
| NaAlO2溶液中逐滴滴加盐酸至过量 | AlCl3溶液中逐滴滴加氨水至过量 | 明矾[KAl(SO4)2•12H2O]溶液中逐滴滴加Ba(OH)2溶液至过量 | 澄清石灰水中缓慢通入CO2至过量 |
 |  | 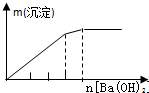 | 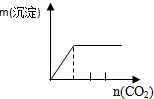 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
分析 A.向偏铝酸钠溶液中加入稀盐酸:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,Al(OH)3+3HCl=AlCl3+3H2O,先产生沉淀,后沉淀溶解,所用稀盐酸溶液体积为1:3;
B.向AlCl3溶液中加氨水:AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl,逐渐产生沉淀,且沉淀不溶解;
C.向KAl(SO4)2中滴加Ba(OH)2:先生成BaSO4和Al(OH)3,再加入Ba(OH)2生成BaSO4的同时Al(OH)3溶解(此时生成沉淀的速度比前面减小),最后Al(OH)3溶解完,只剩余BaSO4沉淀,产生沉淀先快,再慢,最后不变;
D.向石灰水中通入二氧化碳:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,先产生沉淀,后沉淀溶解,所用二氧化碳体积为1:1.
解答 解:A.向偏铝酸钠溶液中加入稀盐酸:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,Al(OH)3+3HCl=AlCl3+3H2O,先产生沉淀,后沉淀溶解,所用稀盐酸溶液体积为1:3;A与图象不符,故A错误;
B.向AlCl3溶液中加氨水:AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl,逐渐产生沉淀,且沉淀不溶解;B与图象不符,故B错误;
C.向KAl(SO4)2中滴加Ba(OH)2:先生成BaSO4和Al(OH)3,再加入Ba(OH)2生成BaSO4的同时Al(OH)3溶解(此时生成沉淀的速度比前面减小),最后Al(OH)3溶解完,只剩余BaSO4沉淀,产生沉淀先快,再慢,最后不变,C与图象相符,故C正确;
D.向石灰水中通入二氧化碳:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,先产生沉淀,后沉淀溶解,所用二氧化碳体积为1:1;D与图象不符,故D错误;
故选C.
点评 本题考查加入试剂或通入气体的体积与产生沉淀的物质的量的关系,先写出有关的反应式,然后根据反应物的物质的量之比确定图象.

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案| A. | 1:3 | B. | 1:4 | C. | 1:5 | D. | 1:6 |
| A. | 标准状况下,44.8L乙醇中含有的分子数目为0.2NA | |
| B. | 常温常压下,6.4gSO2中含有的氧原子数目为0.2NA | |
| C. | 1L0.1mol•L-1K2CO3溶液中含有的钾离子数目为0.1NA | |
| D. | 100mL1.0mol•L-1FeCl3溶液与足量铜反应,转移的电子数目为0.2NA |
| A. | Ca(ClO)2(aq)$\stackrel{CO_{2}}{→}$HClO(aq)$\stackrel{光照}{→}$HCl(aq) | |
| B. | NaCl(饱和)$\stackrel{NH_{3}、CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | Al2O3$\stackrel{NaOH(aq)}{→}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| D. | NaAlO2(aq)$\stackrel{过量盐酸}{→}$AlCl3$\stackrel{电解}{→}$Al |
 氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料.
氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料.(1)纳米级的Cu2O可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H=+484kJ•mol-1,不同时段产生O2的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
(2)氢气是合成氨工业的原料,合成塔中每产生2mol NH3,放出92.2kJ热量.已知:则1mol N-H键断裂吸收的能量约等于391 kJ.
(3)已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/molN2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol则H2还原NO2生成水蒸气和氮气反应的热化学方程式是4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1034.9kJ/mol放电充电
(4)氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池.氢镍电池的总反应式是 H2+2NiO(OH)?2Ni(OH)2.请由总反应式回答:
①电解质溶液应该是碱溶液(选填酸溶液、碱溶液),
②电池放电时,负极反应式为H2-2e-+2OH-=2H2O,
③外电路中每通过0.2NA个电子时,H2的质量理论上减小0.2g,
④电池工作时,电子由负极通过外电路流向正极(选填正、负).
(1)反应C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是BC.
A.增加碳的用量 B.升高温度 C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1
则反应 CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1.
(3)CO与H2一定条件下反应生成甲醇(CH3OH),可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,该电池负极反应式为CH3OH(g)+H2O-6e-=CO2+6H+.
(4)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②该温度下,此反应的平衡常数K=$\frac{9}{25}$;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数不变(填“增大”、“减小”或“不变”).
| A. | 玻璃钢是复合材料 | B. | 铝是黑色金属材料 | ||
| C. | 石英是半导体材料 | D. | 水泥是新型无机非金属材料 |