题目内容
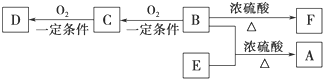
有4种固体A、B、C、D将它们分别加水,均得到无色液体,测得A溶液有强碱性,D溶于水时可得强碱并放出无色气体F,将它们的溶液进行焰色反应,则A、B、C的焰色均成浅紫色;D的焰色为黄色,A、B、C溶液中加入盐酸,则B、C溶液均有气体E放出,A则放热而无明显现象,气体E为无色、无味气体,但遇Ba(OH)2 溶液出现白色沉淀,又知反应:①溶液中:A+B→C;②B(固体)
E+H2O+C; ③C+E溶液→B溶液;④E+A溶液(不足量)→B;⑤E+A溶液(过量)→C溶液;⑥D+E→F+固体.试回答:
(1)写出化学是:A B C D E ;
(2)写出离子方程式:反应① ,反应③ .
| 加热 |
(1)写出化学是:A
(2)写出离子方程式:反应①
考点:无机物的推断
专题:推断题
分析:A、B、C的焰色均成浅紫色,应含有K元素;A、B、C溶液中加入盐酸,则B、C溶液均有气体E放出,气体E为无色、无味气体,但遇Ba(OH)2 溶液出现白色沉淀,则E为CO2,由反应②可知B不稳定,应为KHCO3,则C为K2CO3,由①溶液中:A+B→C可知A应为KOH,D的焰色为黄色,含有Na元素,D溶于水时可得强碱并放出无色气体F,可知D为Na2O2,F为O2,以此解答该题.
解答:
解:A、B、C的焰色均成浅紫色,应含有K元素;A、B、C溶液中加入盐酸,则B、C溶液均有气体E放出,气体E为无色、无味气体,但遇Ba(OH)2 溶液出现白色沉淀,则E为CO2,由反应②可知B不稳定,应为KHCO3,则C为K2CO3,由①溶液中:A+B→C可知A应为KOH,D的焰色为黄色,含有Na元素,D溶于水时可得强碱并放出无色气体F,可知D为Na2O2,F为O2,
(1)由以上分析可知A为KOH,B为KHCO3,C为K2CO3,D为Na2O2,E为CO2,故答案为:KOH;KHCO3;K2CO3;Na2O2;CO2;
(2)反应①为KOH和KHCO3的反应,反应的离子方程式为HCO3-+OH-═CO32-+H2O,反应③为K2CO3和二氧化碳的反应,反应的离子方程式为CO32-+H2O+CO2=2HCO3-,
故答案为:HCO3-+OH-═CO32-+H2O;CO32-+H2O+CO2=2HCO3-.
(1)由以上分析可知A为KOH,B为KHCO3,C为K2CO3,D为Na2O2,E为CO2,故答案为:KOH;KHCO3;K2CO3;Na2O2;CO2;
(2)反应①为KOH和KHCO3的反应,反应的离子方程式为HCO3-+OH-═CO32-+H2O,反应③为K2CO3和二氧化碳的反应,反应的离子方程式为CO32-+H2O+CO2=2HCO3-,
故答案为:HCO3-+OH-═CO32-+H2O;CO32-+H2O+CO2=2HCO3-.
点评:本题考查无机物的推断,为高频考点,侧重于学生的分析能力的考查,注意把握物质的颜色以及反应的特点,为解答该题的关键,难度不大.

练习册系列答案
相关题目
工业上生产MnO2和Zn的主要反应有:①MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O②MnSO4+ZnSO4+2H2O
MnO2+Zn+2H2SO4下列说法不正确的是( )
| ||
| A、①中MnO2和H2SO4都是氧化剂 |
| B、MnSO4的还原性小于Zn的还原性 |
| C、②中MnSO4发生氧化反应 |
| D、硫酸在该生产中可循环利用 |
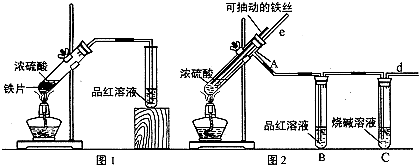
下列实验设计和结论相符的是( )
| A、测定中和热:取25 mL0.25 mol/L的硫酸溶液和25 mL0.5 mol/LNaOH溶液中和,测定反应放出的热 |
| B、在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液 |
| C、将SO2与CO2的混合气通过品红溶液洗气后,可除去CO2中的SO2 |
| D、向含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2溶液,充分反应后过滤,可除去Ca(OH)2 |
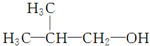 )和甲酸在一定条件下制取E.该反应的化学方程式是
)和甲酸在一定条件下制取E.该反应的化学方程式是
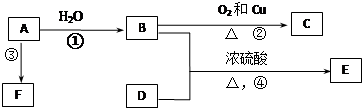 下列各有机物转化关系如图,A具有催热水果的作用;D能使石蕊试液变红;E是不溶于水的E是不溶于水且具有香味的无色液体,相对分子质量是C的2倍;F是高分子化合物,常用于制食品包装袋.结合如图关系回答问题:
下列各有机物转化关系如图,A具有催热水果的作用;D能使石蕊试液变红;E是不溶于水的E是不溶于水且具有香味的无色液体,相对分子质量是C的2倍;F是高分子化合物,常用于制食品包装袋.结合如图关系回答问题: