题目内容
某校化学小组为探究铁与浓硫酸反应,设计了图1、图2两套装置进行实验.
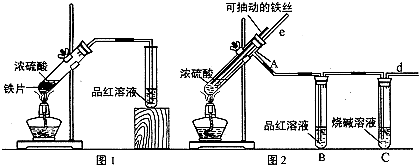
(1)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是 ;
(2)比较两套实验装置,图2装置还有的优点是:① ;② ;
(3)能说明有SO2气体产生的实验现象是
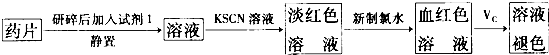
(4)反应一段时间后,用滴管吸取A试管中溶液滴入适量水中为试样,试样中所含金属离子的成分有以下三种可能:
I:只含有Fe3+II:只含有Fe2+Ⅲ:既有Fe3+又有Fe2+为验证Ⅱ、Ⅲ的可能性,请填写下列空格:
验证Ⅱ:取试样,先滴加少量的KSCN溶液,再滴加少量试剂X,若溶液颜色先为无色后变为红色,则试样中只含有Fe2+.试剂X为 ;
验证Ⅲ:
步骤1.取试样,滴加少量的KSCN溶液,溶液变红色,则试样中含有Fe3+;
步骤2. 则试样中含有Fe2+,
此反应的离子方程式为 .

(1)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是
(2)比较两套实验装置,图2装置还有的优点是:①
(3)能说明有SO2气体产生的实验现象是
(4)反应一段时间后,用滴管吸取A试管中溶液滴入适量水中为试样,试样中所含金属离子的成分有以下三种可能:
I:只含有Fe3+II:只含有Fe2+Ⅲ:既有Fe3+又有Fe2+为验证Ⅱ、Ⅲ的可能性,请填写下列空格:
验证Ⅱ:取试样,先滴加少量的KSCN溶液,再滴加少量试剂X,若溶液颜色先为无色后变为红色,则试样中只含有Fe2+.试剂X为
验证Ⅲ:
步骤1.取试样,滴加少量的KSCN溶液,溶液变红色,则试样中含有Fe3+;
步骤2.
此反应的离子方程式为
考点:性质实验方案的设计
专题:
分析:(1)导气管e与外界连通能起到平衡压强防止倒吸的作用;
(2)对比图Ⅱ实验装置与图Ⅰ装置,得出图Ⅱ实验装置的优点;
(3)二氧化硫具有漂白性,可使品红褪色;
(4)验证Ⅱ:X的作用是把亚铁离子转化为铁离子,铁离子遇硫氰化钾变红色;
验证Ⅲ:分别根据检验亚铁离子、铁离子的常用方法进行设计检验方案.
(2)对比图Ⅱ实验装置与图Ⅰ装置,得出图Ⅱ实验装置的优点;
(3)二氧化硫具有漂白性,可使品红褪色;
(4)验证Ⅱ:X的作用是把亚铁离子转化为铁离子,铁离子遇硫氰化钾变红色;
验证Ⅲ:分别根据检验亚铁离子、铁离子的常用方法进行设计检验方案.
解答:
解:(1)导气管e与外界连通能起到平衡压强防止倒吸的作用,
故答案为:停止加热时,防止倒吸或平衡压强;
(2)根据图示装置可知,图Ⅱ实验装置比图Ⅰ能更好地吸收有毒气体SO2,防止其污染环境;图Ⅰ不能控制反应的进行,而图Ⅱ可以随开随停,便于控制反应的进行,避免了资源浪费,减少了污染物生成,
故答案为:能更好的吸收有毒气体SO2,防止其污染环境;便于控制反应的发生和停止
(3)二氧化硫具有漂白性,可使品红褪色,品红溶液褪色或颜色变浅,说明有二氧化硫生成,故答案为:品红溶液褪色或颜色变浅;
(4)验证Ⅱ:欲证明某溶液中不含Fe3+可能含有Fe2+,应加入硫氰酸钾溶液无现象,加入氯水或过氧化氢溶液将亚铁离子氧化成铁离子,变为血红色证明不含有铁离子,可能含有亚铁离子,
故答案为:新制氯水或过氧化氢溶液;
验证Ⅲ:检验溶液中是否含有铁离子、亚铁离子,可以使用硫氰化钾溶液检验铁离子,若溶液变红,则含有Fe3+,
然后使用稀硫酸和高锰酸钾溶液检验亚铁离子,KMnO4溶液紫红色褪去或变浅,则含有Fe2+,反应的离子方程式为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,
故答案为:取适量的试样,滴加到少量酸性高锰酸钾溶液中,溶液的颜色由紫红色褪去或变浅;5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O.
故答案为:停止加热时,防止倒吸或平衡压强;
(2)根据图示装置可知,图Ⅱ实验装置比图Ⅰ能更好地吸收有毒气体SO2,防止其污染环境;图Ⅰ不能控制反应的进行,而图Ⅱ可以随开随停,便于控制反应的进行,避免了资源浪费,减少了污染物生成,
故答案为:能更好的吸收有毒气体SO2,防止其污染环境;便于控制反应的发生和停止
(3)二氧化硫具有漂白性,可使品红褪色,品红溶液褪色或颜色变浅,说明有二氧化硫生成,故答案为:品红溶液褪色或颜色变浅;
(4)验证Ⅱ:欲证明某溶液中不含Fe3+可能含有Fe2+,应加入硫氰酸钾溶液无现象,加入氯水或过氧化氢溶液将亚铁离子氧化成铁离子,变为血红色证明不含有铁离子,可能含有亚铁离子,
故答案为:新制氯水或过氧化氢溶液;
验证Ⅲ:检验溶液中是否含有铁离子、亚铁离子,可以使用硫氰化钾溶液检验铁离子,若溶液变红,则含有Fe3+,
然后使用稀硫酸和高锰酸钾溶液检验亚铁离子,KMnO4溶液紫红色褪去或变浅,则含有Fe2+,反应的离子方程式为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,
故答案为:取适量的试样,滴加到少量酸性高锰酸钾溶液中,溶液的颜色由紫红色褪去或变浅;5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O.
点评:本题考查了浓硫酸的性质、铁离子、亚铁离子的检验方法,题目难度中等,明确检验铁离子、亚铁离子的检验方法是解题关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系,下列有关说法正确的是( )
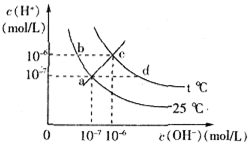

| A、c点对应的溶液中大量存在的离子可能为:Na+、Al3+、Cl-、CO32- |
| B、将25℃时的NaCl溶液加热到t℃,则该溶液中的c(OH-)由a点变化到b点 |
| C、t℃>25℃ |
| D、ac线上的任意一点均有pH=7 |
硫-钠原电池具有输出功率较高,循环寿命长等优点.其工作原理可表示为:2Na+xS
Na2Sx.但工作温度过高是这种高性能电池的缺陷,科学家研究发现,采用多硫化合物(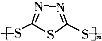 )作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )
)作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )
| 放电 |
| 充电 |
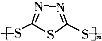 )作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )
)作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )A、多硫化合物(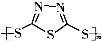 )是一种新型无机非金属材料 )是一种新型无机非金属材料 |
B、多硫化合物(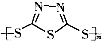 )化合物不能发生加成反应 )化合物不能发生加成反应 |
C、原电池的负极反应是将单体 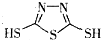 转化为 转化为 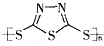 的过程 的过程 |
| D、当电路中有0.02mol电子通过时,原电池的负极将消耗原料0.46g |
设NA为阿伏加德罗常数,下列说法不正确的是( )
| A、1molNa变成Na+时失去的电子数为NA |
| B、12g12C中所含12C的数目为NA |
| C、CaCl2溶液中若含有1.5NA个Ca2+,则含有3NA个Cl- |
| D、11.2LN2中含有的氮原子数目为NA |