题目内容
用惰性电极电解一段时间后(溶质都有剩余),甲、乙两池串联且甲乙两池中溶液的pH变化趋势相同,且两阳极、两阴极的反应产物的物质的量分别相等的是( )
| A | B | C | D | |
| 甲 池 | H2SO4(aq) | CuCl2(aq) | HCl(aq) | NaOH(aq) |
| 乙 池 | AgNO3(aq) | K2SO4(aq) | NaCl(aq) | CuSO4(aq) |
| A、A | B、B | C、C | D、D |
考点:电解原理
专题:电化学专题
分析:工作一段时间后甲、乙两池串联且甲乙两池中溶液的pH变化趋势相同,且两阳极、两阴极的反应产物的物质的量分别相等.
A、甲池是电解硫酸溶液,实质是电解水,pH下降,阴极电极反应为:2H++2e-=H2,阳极电极反应为:4OH--4e-=2H2O+O2↑;乙池电解硝酸银溶液,溶液pH减小,阴极电解反应为:2Ag++2e-=2Ag,阳极电极反应为:4OH--4e-=2H2O+O2↑;
B、甲池是电解氯化铜,阴极电解反应为:Cu2++2e-=Cu,阳极电极反应为:2Cl--2e-=Cl2↑;乙池电解硫酸钾实际是电解水,pH不变;阳极生成氧气,阴极生成氢气;
C、甲池电解盐酸,生成氢气和氯气,pH升高,乙池电解氯化钠溶液,生成氢氧化钠、氢气和氯气,pH升高;
D、电解氢氧化钠溶液,实际是电解水,pH增大,生成氢气和氧气;电解硫酸铜溶液,溶液pH减小,生成铜和氧气.
A、甲池是电解硫酸溶液,实质是电解水,pH下降,阴极电极反应为:2H++2e-=H2,阳极电极反应为:4OH--4e-=2H2O+O2↑;乙池电解硝酸银溶液,溶液pH减小,阴极电解反应为:2Ag++2e-=2Ag,阳极电极反应为:4OH--4e-=2H2O+O2↑;
B、甲池是电解氯化铜,阴极电解反应为:Cu2++2e-=Cu,阳极电极反应为:2Cl--2e-=Cl2↑;乙池电解硫酸钾实际是电解水,pH不变;阳极生成氧气,阴极生成氢气;
C、甲池电解盐酸,生成氢气和氯气,pH升高,乙池电解氯化钠溶液,生成氢氧化钠、氢气和氯气,pH升高;
D、电解氢氧化钠溶液,实际是电解水,pH增大,生成氢气和氧气;电解硫酸铜溶液,溶液pH减小,生成铜和氧气.
解答:
解:A、甲池是电解硫酸溶液,实质是电解水,pH下降,阴极电极反应为:2H++2e-=H2,阳极电极反应为:4OH--4e-=2H2O+O2↑;乙池电解硝酸银溶液,溶液pH减小,阴极电解反应为:2Ag++2e-=2Ag,阳极电极反应为:4OH--4e-=2H2O+O2↑,pH变化趋势相同,但两阳极产物的物质的量不同,故A错误;
B、甲池是电解氯化铜,阴极电解反应为:Cu2++2e-=Cu,阳极电极反应为:2Cl--2e-=Cl2↑;乙池电解硫酸钾实际是电解水,pH不变;阳极生成氧气,阴极生成氢气;pH变化趋势不同,阳极产物的物质的量不同,故B错误;
C、甲池电解盐酸,生成氢气和氯气,pH升高,乙池电解氯化钠溶液,生成氢氧化钠、氢气和氯气,pH升高,变化趋势相同,阳极产物物质的量相同,阴极产物物质的量也相同,故C正确;
D、电解氢氧化钠溶液,实际是电解水,pH增大,生成氢气和氧气;电解硫酸铜溶液,溶液pH减小,生成铜和氧气,pH变化趋势不同,故D错误;
故选C.
B、甲池是电解氯化铜,阴极电解反应为:Cu2++2e-=Cu,阳极电极反应为:2Cl--2e-=Cl2↑;乙池电解硫酸钾实际是电解水,pH不变;阳极生成氧气,阴极生成氢气;pH变化趋势不同,阳极产物的物质的量不同,故B错误;
C、甲池电解盐酸,生成氢气和氯气,pH升高,乙池电解氯化钠溶液,生成氢氧化钠、氢气和氯气,pH升高,变化趋势相同,阳极产物物质的量相同,阴极产物物质的量也相同,故C正确;
D、电解氢氧化钠溶液,实际是电解水,pH增大,生成氢气和氧气;电解硫酸铜溶液,溶液pH减小,生成铜和氧气,pH变化趋势不同,故D错误;
故选C.
点评:本题考查了电解原理的应用,明确电极反应是解题关键,题目难度中等.

练习册系列答案
相关题目
某同学在实验室进行了如图所示的实验,下列说法中错误的是( )

| A、利用过滤的方法,可将Z中固体与液体分离 |
| B、X、Z烧杯中分散质相同 |
| C、Y中反应的离子方程式为3CaCO3+2Fe3++3H2O=2Fe(OH)3+3 CO2↑+3 Ca2+ |
| D、Z中分散系能产生丁达尔效应 |
下列事实不能用勒夏特列原理解释的是( )
| A、由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| B、高压比常压有利于合成SO3的反应 |
| C、红棕色的NO2,加压后颜色先变深后变浅 |
| D、黄绿色的氯水光照后颜色变浅 |
黄铜矿(CuFeS2)常用于提炼金属铜.黄铜矿焙烧过程中所发生的反应比较复杂,其中主要反应之一的化学方程式为2CuFeS2+O2═□+2FeS+SO2(已配平),则下列关于该反应的说法错误的是( )
| A、方框中的物质应为Cu2S |
| B、该反应的部分产物可用于硫酸工业 |
| C、反应中SO2既是氧化产物又是还原产物 |
| D、反应中若有1 mol SO2生成,则一定有4 mol电子发生转移 |
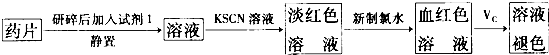
 我国著名化学家侯德榜先生发明的“侯氏制碱法”,因原料利用率高.并能进行连续生产,从而享誉中外.“侯氏制碱法”的基本做法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱.它的反应原理可用下列化学方程式表示:
我国著名化学家侯德榜先生发明的“侯氏制碱法”,因原料利用率高.并能进行连续生产,从而享誉中外.“侯氏制碱法”的基本做法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱.它的反应原理可用下列化学方程式表示: