题目内容
6.已知1.505×1023个X气体分子的质量为8g,则X气体的相对分子质量是( )| A. | 16 | B. | 32 | C. | 64g/mol | D. | 32g/mol |
分析 依据n=$\frac{m}{M}$、N=n×NA来计算M,M以g/mol为单位时数值上等于其相对分子质量.
解答 解:1.505×1023个X气体分子物质的量=$\frac{1.505×10{\;}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.25mol,
$\frac{8g}{M}$=0.25mol,解得M=32g/mol,
因此X气体的相对分子质量是32,
故选B.
点评 本题考查阿伏伽德罗常数的计算,明确质量、物质的量、微粒数目的关系是解答本题的关键,难度不大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
4.对下列两种化合物的描述正确的是( )
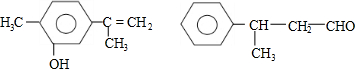
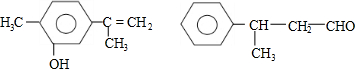
| A. | 可用红外光谱区分,但不能用核磁共振氢谱区分 | |
| B. | 分子中最多都有10个碳原子共平面 | |
| C. | 不是同分异构体 | |
| D. | 均能与溴水反应 |
17.一定量混合物在密闭容器中发生反应mA(g)+nB(g)?pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的$\frac{1}{2}$,当达到新平衡时,B物质的浓度变为原来的1.9倍.则下列说法正确的是( )
| A. | m+n<p | B. | 平衡向逆反应方向移动 | ||
| C. | C的体积分数增大 | D. | A的转化率降低 |
14.已知25℃,四种酸的电离平衡常数如表,下列叙述正确的是( )
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 | Ka=1.75×10-5 | Ka=4.2×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A. | 等物质的量浓度的四种酸溶液中,pH最大的是亚硫酸 | |
| B. | 等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3 | |
| C. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-═$CO_3^{2-}$+2HClO | |
| D. | 醋酸与NaHSO3溶液反应的离子方程式为:CH3COOH+HSO3-═SO2+H2O+CH3COO- |
1.下列说法中,正确的是( )
| A. | 分离酒精和CCl4的混合物,可用分液法 | |
| B. | 从Na2CO3溶液中得到Na2CO3晶体,可用过滤法 | |
| C. | 从I2的CCl4溶液中得到CCl4,可用蒸馏法 | |
| D. | 分离NaCl和AgCl的混合物,可用萃取法 |
18.在化学反应中,反应前与反应后相比较,肯定不变的是( )
①元素的种类 ②如果在水溶液中反应,反应前与反应后阳离子所带的正电荷总数
③分子的数目 ④原子的数目 ⑤反应前物质的质量总和与反应后物质的质量总和.
①元素的种类 ②如果在水溶液中反应,反应前与反应后阳离子所带的正电荷总数
③分子的数目 ④原子的数目 ⑤反应前物质的质量总和与反应后物质的质量总和.
| A. | ①③④ | B. | ②③⑤ | C. | ①④⑤ | D. | ②④⑤ |
16.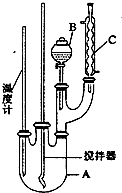 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下: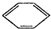 +HO-NO2$→_{50-60℃}^{H_{2}SO_{4}}$
+HO-NO2$→_{50-60℃}^{H_{2}SO_{4}}$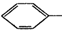 NO2+H2O△H<0
NO2+H2O△H<0
反应中存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.
有关数据列如下表:
实验步骤如下:①取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混和酸,将混合酸小心加入B中;②把18mL(15.84g)苯加入A中;③向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.在50~60℃下发生反应,直至反应结束;④将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液、水洗涤并分液;⑤分出的产物加入无水CaCl2颗粒,静置片刻,然后倒入蒸馏烧瓶,弃去CaCl2,进行蒸馏纯化,收集205~210℃馏分,得到纯硝基苯18g.
回答下列问题:
(1)图中装置C的作用是冷凝回流.
(2)配制混合酸时,能否将浓硝酸加入到浓硫酸中,说明理由:不能,容易发生迸溅.
(3)为了使反应在50℃~60℃下进行,常用的方法是水浴加热.反应结束并冷却至室温后A中液体就是粗硝基苯,粗硝基苯呈黄色的原因是溶有浓硝酸分解产生的NO2(或硝酸)等杂质.
(4)在洗涤操作中,第二次水洗的作用是洗去残留的NaOH及生成的盐.
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用水直形冷凝管的原因是以免直形冷凝管通水冷却时导致温差过大而发生炸裂.
(6)本实验所得到的硝基苯产率是72%.
 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下: +HO-NO2$→_{50-60℃}^{H_{2}SO_{4}}$
+HO-NO2$→_{50-60℃}^{H_{2}SO_{4}}$ NO2+H2O△H<0
NO2+H2O△H<0反应中存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.
有关数据列如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二销基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
回答下列问题:
(1)图中装置C的作用是冷凝回流.
(2)配制混合酸时,能否将浓硝酸加入到浓硫酸中,说明理由:不能,容易发生迸溅.
(3)为了使反应在50℃~60℃下进行,常用的方法是水浴加热.反应结束并冷却至室温后A中液体就是粗硝基苯,粗硝基苯呈黄色的原因是溶有浓硝酸分解产生的NO2(或硝酸)等杂质.
(4)在洗涤操作中,第二次水洗的作用是洗去残留的NaOH及生成的盐.
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用水直形冷凝管的原因是以免直形冷凝管通水冷却时导致温差过大而发生炸裂.
(6)本实验所得到的硝基苯产率是72%.
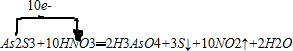 ;
;