题目内容
4.我国农业因遭受酸雨而造成每年损失高达十五多亿元.为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规.(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如表:
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
①雨水样品的pH变化的原因是(用化学反应方程式表示)2H2SO3+O2=2H2SO4
②如果将刚取样的上述雨水和自来水相混合,pH将变小(填“大”或“小”),原因是(用化学方程式表示)SO2+2H2O+Cl2=H2SO4+2HCl.
(2)要测定空气中SO2 的含量,某同学设计如下方案:
将空气以恒定速率x L/min缓慢通入10mL 0.001mol/L酸性高锰酸钾溶液,当一段时间t后通入5m3空气时,溶液恰好褪色(假定空气中其它成分不与酸性高锰酸钾反应).
①写出SO2 与酸性高锰酸钾反应的离子方程式5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+(反应后锰元素以Mn2+ 形式存在).
②SO2 使高锰酸钾溶液褪色体现SO2 的性质是B(填选项)
A.氧化性 B.还原性 C.漂白性 D.酸性氧化物通性
③空气中SO2 的含量为0.32mg/m3
④使溶液褪色所需的时间t越长,则空气中SO2 的含量越小(填“大”或“小”)
分析 (1)①雨水的pH值变小的原因是由于排放出来的SO2等气体溶于水后生成H2SO3,H2SO3随雨水的下降,逐渐被空气中的氧气所氧化生成易电离的H2SO4,2H2SO3+O2=2H2SO4,从而使雨水的酸性增强;
②根据氯气能氧化H2SO3生成硫酸和盐酸,溶液的酸性增强,PH减小;
(2)①二氧化硫具有还原性,能被酸性高锰酸钾氧化为硫酸根离子,据此书写离子方程式;
②二氧化硫具有还原性,能被酸性高锰酸钾氧化;
③根据二氧化硫和高锰酸钾之间的反应进行计算即可;
④使溶液褪色所需的时间t越长,说明二氧化硫的浓度越小,含量越小.
解答 解:(1)①雨水的pH值变小的原因是由于排放出来的SO2等气体溶于水后生成H2SO3,H2SO3随雨水的下降,逐渐被空气中的氧气所氧化生成易电离的H2SO4,方程式为2H2SO3+O2=2H2SO4,从而使雨水的酸性增强,故答案为:2H2SO3+O2=2H2SO4;
②因氯气能氧化H2SO3生成硫酸和盐酸,两者都是强酸,酸性增强,PH减小,发生反应:SO2+2H2O+Cl2=H2SO4+2HCl,
故答案为:小;SO2+2H2O+Cl2=H2SO4+2HCl;
(2)①二氧化硫具有还原性,能被酸性高锰酸钾氧化为硫酸根离子,离子方程式为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;故答案为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
②二氧化硫具有还原性,能被酸性高锰酸钾氧化,故选B;
③根据二氧化硫和高锰酸钾之间的反应5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,以恒定速率x L/min缓慢通入10mL 0.001mol/L酸性高锰酸钾溶液,当一段时间t后通入5m3空气时,溶液恰好褪色,高锰酸钾的量是0.01L×0.001mol/L=10-5mol,所以含有的二氧化硫的物质的量是2.5×10-5mol,
④使溶液褪色所需的时间t越长,说明二氧化硫的浓度越小,含量越小2.5×10-5mol,空气中SO2 的含量为$\frac{2.5×1{0}^{-5}mol×64g/mol}{5}$=0.00032g/m3=0.32mg/m3,
故答案为:0.32;
④使溶液褪色所需的时间t越长,说明二氧化硫的浓度越小,含量越小,故答案为:小.
点评 本题比较简单,主要考查了酸雨的有关知识,注意二氧化硫的性质的灵活应用是关键,难度不大.

| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 | Ka=1.75×10-5 | Ka=4.2×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A. | 等物质的量浓度的四种酸溶液中,pH最大的是亚硫酸 | |
| B. | 等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3 | |
| C. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-═$CO_3^{2-}$+2HClO | |
| D. | 醋酸与NaHSO3溶液反应的离子方程式为:CH3COOH+HSO3-═SO2+H2O+CH3COO- |
| A. | 澄清透明的无色溶液:MnO4- Na+ I- Mg2+ | |
| B. | 含有0.1mol/L Fe3+ 的溶液中:Na+ Ca2+ SCN- SO42- | |
| C. | 与铝片反应产生氢气的溶液:CO32- SO42- Na+ NH4+ | |
| D. | 使酚酞溶液变红的溶液:Na+ Cl- NO3- Ba2+ |
| A. | 在空气中敞口久置的浓硫酸,溶液质量增大(难挥发性) | |
| B. | 在加热条件下铜与浓硫酸反应(强氧化性、酸性) | |
| C. | 蔗糖与浓硫酸反应中有海绵状的炭生成(吸水性) | |
| D. | 浓硫酸与少量胆矾晶体混合,晶体由蓝色变成白色(脱水性) |
 一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)=AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )
一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)=AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )| A. | 光照时,电流由Y流向X | |
| B. | 光照时,Pt电极发生的反应为2Cl-+2e-═Cl2 | |
| C. | 光照时,Cl-向Ag电极移动 | |
| D. | 光照时,电池总反应为:AgCl(s)+Cu+(aq)$\frac{\underline{\;光\;}}{\;}$Ag (s)+Cu2+(aq)+Cl-(aq) |
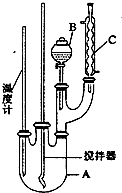 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下: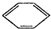 +HO-NO2$→_{50-60℃}^{H_{2}SO_{4}}$
+HO-NO2$→_{50-60℃}^{H_{2}SO_{4}}$ NO2+H2O△H<0
NO2+H2O△H<0反应中存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.
有关数据列如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二销基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
回答下列问题:
(1)图中装置C的作用是冷凝回流.
(2)配制混合酸时,能否将浓硝酸加入到浓硫酸中,说明理由:不能,容易发生迸溅.
(3)为了使反应在50℃~60℃下进行,常用的方法是水浴加热.反应结束并冷却至室温后A中液体就是粗硝基苯,粗硝基苯呈黄色的原因是溶有浓硝酸分解产生的NO2(或硝酸)等杂质.
(4)在洗涤操作中,第二次水洗的作用是洗去残留的NaOH及生成的盐.
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用水直形冷凝管的原因是以免直形冷凝管通水冷却时导致温差过大而发生炸裂.
(6)本实验所得到的硝基苯产率是72%.
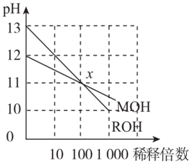
| A. | ROH是一种强碱,MOH是一种弱碱 | |
| B. | 等浓度的MOH与盐酸反应,所得溶液呈中性,则V(MOH)>V(盐酸) | |
| C. | 在x点,c(M+)=c(R+) | |
| D. | 稀释前,c(ROH)=10c(MOH) |
| A. | 在相同条件下的溶解度:NaHCO3>Na2CO3 | |
| B. | 热稳定性:HF>HCl>HBr>HI | |
| C. | 氧化性:F2>Cl2>Br2>I2 | |
| D. | 碳酸钠溶液与稀盐酸互滴时,两种操作现象不相同 |
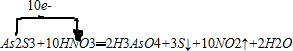 ;
;