题目内容
13.11克铁粉和铝粉的混合物跟足量的稀硫酸反应,共产生氢气8.96升(标准状况),混合物中铁有多少克?若将此混合物跟足量的氢氧化钠溶液反应,能产生氢气多少mol?分析 根据n=$\frac{V}{{V}_{m}}$计算出标况下8.96L氢气的物质的量;设出铝和铁的物质的量,然后分别根据氢气的物质的量、金属总质量列式计算;Fe不与氢氧化钠溶液反应,只有Al反应,根据电子守恒计算出生成氢气的物质的量.
解答 解:标况下8.96L氢气的物质的量为:$\frac{8.96L}{22.4L/mol}$=0.4mol,
设混合物中含有铁和铝的物质的量分别为x、y,
根据总质量可得:56x+27y=11,
根据生成氢气的物质的量可得:x+1.5y=0.4,
联立解得:x=0.1mol、y=0.2mol,
所以混合物中铁的质量为:56g/mol×0.1mol=5.6g;
若将此混合物跟足量的氢氧化钠溶液反应,只有0.2molAl反应,根据电子守恒,生成氢气的物质的量为:$\frac{0.2mol×3}{0.2mol}$=0.3mol,
答:混合物中铁的质量为5.6g;若将此混合物跟足量的氢氧化钠溶液反应,能产生氢气0.3mol.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握质量守恒定律在化学方程式中的应用方法,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
相关题目
3.NH3可用于制造硝酸、纯碱等,还可用于烟气脱硝.
(1)NH3催化氧化可制备硝酸.
①NH3氧化时发生如下反应:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907kJ•mol-1
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1269kJ•mol-1
则4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H3=-1811.63kJ•mol-1
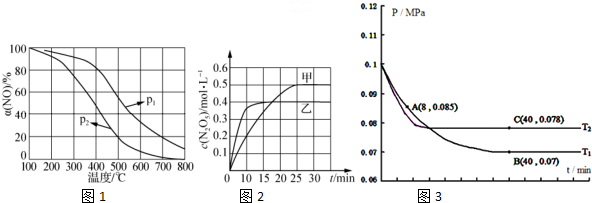
②NO被O2氧化为NO2.其他条件不变时,NO的氧化率[α(NO)2]2 与温度、压强的关系如图1所示.则p1> p2(填“>”、“<”或 1 2“=”);温度高于800℃时,a(NO)几乎为0的原因是NO2几乎完全分解.
(2)臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3?N2O5(g)+O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如表及图2所示:
下列说法正确的是D.
A. 0~10min内甲容器中反应的平均速率:v(NO2)=0.02mol•L-1•min-1
B.T1<T2,△H>0
C,平衡时N2O5浓度:c乙(N2O5)>c丙(N2O5)
D.T1K时,若起始时向容器甲中充入2molNO2、1molO3、2molN2O5和2mol O2,则脱硝反应达到平衡前,v(正)<v(逆)
(3)工业上合成氨通常在反应未达到平衡时就将反应混合物移出合 成塔,原因是能提高单位时间内氨的产量.
(4)SO 经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g)+O2 (g)?2SO2(g).若在 T1℃、0.1MPa条件下,往一密闭容器通入 SO2和O2(其中 n(SO2 ):n(O 2)=2:1),测得容器内总压强与反应时间如图3所示:
①图中 A点时,SO2的转化率为45%.
②计算SO2催化氧化反应在图中 B点的压强平衡常数 K=24300(MPa)-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,并写上单位).
②若在 T℃,其他条件不变的情况下测得压强的变化曲线如图所示,其中 C点的正反应速率vc(正)与 A点的逆反应速率vA(逆)的大小关系为 vc (正)> vA(逆 ) (填“>”、“<”、“=”).

(1)NH3催化氧化可制备硝酸.
①NH3氧化时发生如下反应:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907kJ•mol-1
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1269kJ•mol-1
则4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H3=-1811.63kJ•mol-1
②NO被O2氧化为NO2.其他条件不变时,NO的氧化率[α(NO)2]2 与温度、压强的关系如图1所示.则p1> p2(填“>”、“<”或 1 2“=”);温度高于800℃时,a(NO)几乎为0的原因是NO2几乎完全分解.
(2)臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3?N2O5(g)+O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如表及图2所示:
| 容器 | 甲 | 乙 | 丙 |
| 容积/L | 1 | 1 | 2 |
| 反应物起始量 | 1molO3、2molO2 | ||
| 1molO3、2molNO2 | |||
| 1molO3、2molN2O5 | |||
| 温度/K | T1 | T2 | T2 |
A. 0~10min内甲容器中反应的平均速率:v(NO2)=0.02mol•L-1•min-1
B.T1<T2,△H>0
C,平衡时N2O5浓度:c乙(N2O5)>c丙(N2O5)
D.T1K时,若起始时向容器甲中充入2molNO2、1molO3、2molN2O5和2mol O2,则脱硝反应达到平衡前,v(正)<v(逆)
(3)工业上合成氨通常在反应未达到平衡时就将反应混合物移出合 成塔,原因是能提高单位时间内氨的产量.
(4)SO 经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g)+O2 (g)?2SO2(g).若在 T1℃、0.1MPa条件下,往一密闭容器通入 SO2和O2(其中 n(SO2 ):n(O 2)=2:1),测得容器内总压强与反应时间如图3所示:
①图中 A点时,SO2的转化率为45%.
②计算SO2催化氧化反应在图中 B点的压强平衡常数 K=24300(MPa)-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,并写上单位).
②若在 T℃,其他条件不变的情况下测得压强的变化曲线如图所示,其中 C点的正反应速率vc(正)与 A点的逆反应速率vA(逆)的大小关系为 vc (正)> vA(逆 ) (填“>”、“<”、“=”).
4.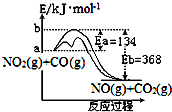 已知某反应的能量变化如图.在不同温度下,反应物初始浓度与初始反应速率有如表关系.
已知某反应的能量变化如图.在不同温度下,反应物初始浓度与初始反应速率有如表关系.
下列有关该反应的叙述错误的是( )
 已知某反应的能量变化如图.在不同温度下,反应物初始浓度与初始反应速率有如表关系.
已知某反应的能量变化如图.在不同温度下,反应物初始浓度与初始反应速率有如表关系.| 实验序号 | 1 | 2 | 3 | 4 | |
| c(NO2)/mol•L-1 | 1 | 1 | 2 | 2 | |
| c(CO)/mol•L-1 | 1 | 2 | 1 | 2 | |
| v/mol•L-1•s-1 | 750K | p | 2p | 2p | 4p |
| 500K | q | q | 4q | 4q | |
| A. | 不同温度下,增加反应物的浓度不一定可以加快反应速率 | |
| B. | 加入催化剂,改变了反应的途径,加快了反应速率 | |
| C. | 升高反应温度,加快了反应速率,增大了平衡常数 | |
| D. | 750K时,将实验2的容器体积缩小一半,速率v为8p mol•L-1•s-1 |
8.下列物质属于纯净物的是( )
| A. | 铝热剂 | B. | 生铁 | C. | 绿矾 | D. | 钢 |
18.用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,下列说法不正确的是( )
| A. | 18O 存在于水中 | |
| B. | 反应中浓硫酸即是催化剂又是脱水剂 | |
| C. | 18O 存在于乙酸乙酯中 | |
| D. | 若与丙酸反应生成的酯的相对分子质量为104 |
5.从某微粒的原子结构示意图反映出( )
| A. | 质子数和中子数 | |
| B. | 核电荷数和核外电子层排布的电子数 | |
| C. | 中子数和电子数 | |
| D. | 质量数和核外电子层排布的电子数 |
2.已知三种有机物存在如下转化关系:
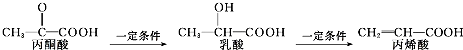
下列叙述错误的是( )

下列叙述错误的是( )
| A. | 三种有机物中都存在2种官能团 | |
| B. | 乳酸和丙烯酸都能使高锰酸钾酸性溶液褪色 | |
| C. | 1mol乳酸最多能与2molNa发生反应 | |
| D. | 三种有机物均能发生加聚反应 |


 +(2n-1)H2O.有机物乙在水中的溶解情况是易溶于水(填“不溶于水”、“微溶于水”、“易溶于水”).
+(2n-1)H2O.有机物乙在水中的溶解情况是易溶于水(填“不溶于水”、“微溶于水”、“易溶于水”). +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$
 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ +H2
+H2 .
. .(如不能发生反应,请填“否”;如能发生反应请写出其反应的方程式)
.(如不能发生反应,请填“否”;如能发生反应请写出其反应的方程式)