题目内容
3.NH3可用于制造硝酸、纯碱等,还可用于烟气脱硝.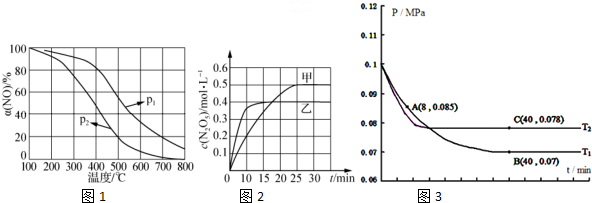
(1)NH3催化氧化可制备硝酸.
①NH3氧化时发生如下反应:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907kJ•mol-1
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1269kJ•mol-1
则4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H3=-1811.63kJ•mol-1
②NO被O2氧化为NO2.其他条件不变时,NO的氧化率[α(NO)2]2 与温度、压强的关系如图1所示.则p1> p2(填“>”、“<”或 1 2“=”);温度高于800℃时,a(NO)几乎为0的原因是NO2几乎完全分解.
(2)臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3?N2O5(g)+O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如表及图2所示:
| 容器 | 甲 | 乙 | 丙 |
| 容积/L | 1 | 1 | 2 |
| 反应物起始量 | 1molO3、2molO2 | ||
| 1molO3、2molNO2 | |||
| 1molO3、2molN2O5 | |||
| 温度/K | T1 | T2 | T2 |
A. 0~10min内甲容器中反应的平均速率:v(NO2)=0.02mol•L-1•min-1
B.T1<T2,△H>0
C,平衡时N2O5浓度:c乙(N2O5)>c丙(N2O5)
D.T1K时,若起始时向容器甲中充入2molNO2、1molO3、2molN2O5和2mol O2,则脱硝反应达到平衡前,v(正)<v(逆)
(3)工业上合成氨通常在反应未达到平衡时就将反应混合物移出合 成塔,原因是能提高单位时间内氨的产量.
(4)SO 经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g)+O2 (g)?2SO2(g).若在 T1℃、0.1MPa条件下,往一密闭容器通入 SO2和O2(其中 n(SO2 ):n(O 2)=2:1),测得容器内总压强与反应时间如图3所示:
①图中 A点时,SO2的转化率为45%.
②计算SO2催化氧化反应在图中 B点的压强平衡常数 K=24300(MPa)-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,并写上单位).
②若在 T℃,其他条件不变的情况下测得压强的变化曲线如图所示,其中 C点的正反应速率vc(正)与 A点的逆反应速率vA(逆)的大小关系为 vc (正)> vA(逆 ) (填“>”、“<”、“=”).
分析 (1)①4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJ•mol-1;②4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1 269.02kJ•mol-1;目标反应的反应热为:$\frac{②×5-①×3}{2}$,由此分析解答;
②温度相同时p1的一氧化氮的氮率大,所以增大压强平衡正向移动;α(NO)几乎为0的原因是无二氧化氮,NO2几乎完全分解;
(2)A. 图象分析可知,N2O5(g)生产浓度0.5mol/L,则消耗NO2浓度1.0mol/L,计算v(NO2)在0~10min内甲容器中反应的平均速率=$\frac{△c}{△t}$;
B.先拐先平温度高,T1<T2,温度越高N2O5(g)浓度越小,结合平衡移动原理分析;
C.结合三行计算列式计算浓度,化学反应达到平衡状态不能进行彻底分析;
D.若起始时向容器甲中充入2molNO2、1molO3、2molN2O5和2mol O2,计算浓度商Qc和平衡常数比较判断反应进行的方向;
(3)分离生成物促进平衡正向进行提高生产效率;
(4)①结合化学三行计算列式,依据图中A点时,气体物质的量0.085,依据开始和A点气体物质的量之比列式计算,转化率=$\frac{消耗量}{起始量}$×100%;
②图中B点,依据化学三行列式计算,设氧气消耗物质的量为y,
2SO2(g)+O2(g)?2SO3
起始量(mol) 2a a 0
变化量(mol) 2y y 2y
平衡量(mol)2a-2y a-y 2y
B点气体物质的量为 0.007,则$\frac{2a-2y+a-y+2y}{2a+a}$=$\frac{0.07}{0.1}$
y=0.9a,
用平衡分压代替平衡浓度计算,分压=总压×物质的量分数计算SO2催化氧化反应在图中B点的压强平衡常数;
③先拐先平温度高,达到平衡所需时间短,温度越高反应速率越大.
解答 解:(1)①4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJ•mol-1;②4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1 269.02kJ•mol-1;目标反应的反应热为:$\frac{②×5-①×3}{2}$=1811.63 kJ•mol-1,故答案为:1811.63 kJ•mol-1;
②温度相同时p1的一氧化氮的氮率大,所以增大压强平衡正向移动,所以p1>p2;α(NO)几乎为0的原因是无二氧化氮,NO2几乎完全分解;
故答案为:>;NO2几乎完全分解;
(2)2NO2(g)+O3?N2O5(g)+O2(g),
A. 图象分析可知,N2O5(g)生产浓度0.5mol/L,则消耗NO2浓度1.0mol/L,v(NO2)在0~10min内甲容器中反应的平均速率=$\frac{1.0mol/L}{10min}$0.1mol/L•min,故A错误;
B.先拐先平温度高,T1<T2,温度越高N2O5(g)浓度越小,说明温度升高平衡逆向进行,则反应△H<0,故B错误;
C,乙中依据化学三行计算得到,
2NO2(g)+O3?N2O5(g)+O2(g),
2 1 0 0
0.8 0.4 0.4 0.4
1.2 0.6 0.4 0.4
丙中2NO2(g)+O3?N2O5(g)+O2(g),
1 2 0
平衡时N2O5浓度:c乙(N2O5)<c丙(N2O5),故C错误;
D.若起始时向容器甲中充入2molNO2、1molO3、2molN2O5和2mol O2,计算浓度商Qc=$\frac{2×2}{{2}^{2}×1}$=1,相当于加入五氧化二氮反应逆向进行,则脱硝反应达到平衡前,v(正)<v(逆),故D正确;
故答案为:D.
(3)工业上合成氨通常在反应未达到平衡时就将反应混合物移出合成塔,促进平衡正向进行,能提高单位时间内氨的产量,
故答案为:能提高单位时间内氨的产量;
(4)①依据化学三行列式计算,设氧气消耗物质的量为x,
2SO2(g)+O2(g)?2SO3
起始量(mol) 2a a 0
变化量(mol) 2x x 2x
平衡量(mol)2a-2x a-x 2x
图中A点时,气体物质的量0.085,则$\frac{2a-2y+a-y+2y}{2a+a}$=$\frac{0.085}{0.1}$
x=0.45a
SO2的转化率=$\frac{0.45a×2}{2a}$×100%=45%,
故答案为:45%;
②图中B点,依据化学三行列式计算,设氧气消耗物质的量为y,
2SO2(g)+O2(g)?2SO3
起始量(mol) 2a a 0
变化量(mol) 2y y 2y
平衡量(mol)2a-2y a-y 2y
B点气体物质的量为 0.007,则$\frac{2a-2y+a-y+2y}{2a+a}$=$\frac{0.07}{0.1}$
y=0.9a,
平衡常数K=$\frac{(0.007MPa×\frac{1.8a}{0.2a+0.1a+1.8a})^{2}}{(0.007MPa×\frac{0.2a}{0.2a+0.1a+1.8a})^{2}×\frac{0.1a}{0.2a+0.1a+1.8a}}$=24300(MPa)-1,
故答案为:24300(MPa)-1;
③图象分析可知,先拐先平温度高则T1<T2,C点是平衡状态,A点反应未达到平衡状态,其中C点的正反应速率vC(正)与A点的逆反应速率vA(逆)的大小关系为vC(正)>vA(逆)
故答案为:>.
点评 本题考查了化学平衡、化学反应速率影响因素的分析应用,图象变化和数值的计算是解题关键,题目难度中等.

| A. | 中和滴定实验中,如用于装标准液的滴定管洗净、干燥后,未经润洗,测定结果偏高 | |
| B. | 实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 | |
| C. | 纸层析实验中若选择水做固定相,有机溶剂做流动相,则亲水性强的成分在流动相中分配的少一些,在毛细现象作用下,随流动相移动的速度快一些 | |
| D. | 检验新鲜鸡血中的铁元素时,可在鸡血中加入稀硝酸并加热搅拌蒸干得到固体粉末,取少许粉末加入亚铁氰化钾稀溶液,可得蓝色溶液 |
| A. | CuCl2、Cu(NO3)2、Ba(OH)2 | B. | Al、Fe、CuSO4 | ||
| C. | MgSO4、Mg(NO3)2、Ba(OH)2 | D. | Al、Cu、FeSO4 |
| A. | n=$\frac{{M}_{2}-2{M}_{1}}{58}$ | B. | n=$\frac{{M}_{2}-{M}_{1}}{29}$ | C. | n=$\frac{2{M}_{2}-{M}_{1}}{58}$ | D. | n=$\frac{{M}_{2}-{M}_{1}}{58}$ |
| A. | 实验室制乙烯:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$ CH2=CH2↑+H2O | |
| B. | 苯酚钠溶液通入少量CO2:2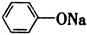 +CO2+H2O→2 +CO2+H2O→2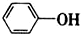 +Na2CO3 +Na2CO3 | |
| C. | 乙酸苯酚酯在足量的NaOH溶液中水解: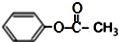 +NaOH→CH3COONa+ +NaOH→CH3COONa+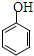 | |
| D. | 工业制聚乙烯:nCH2=CH2 $\stackrel{催化剂}{→}$ |
| A. | 所有醛中都含醛基和烃基 | |
| B. | 一元醛的分子式符合CnH2nO的通式 | |
| C. | 醛的官能团是-COH | |
| D. | 所有醛都能使溴水和酸性KMnO4溶液褪色 |
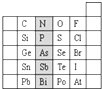 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分. .
.