题目内容
18.用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,下列说法不正确的是( )| A. | 18O 存在于水中 | |
| B. | 反应中浓硫酸即是催化剂又是脱水剂 | |
| C. | 18O 存在于乙酸乙酯中 | |
| D. | 若与丙酸反应生成的酯的相对分子质量为104 |
分析 羧酸跟醇的酯化反应是可逆的,该反应也属于取代反应;羧酸跟醇的反应过程为:羧酸分子中的羟基与醇分子中羟基的氢原子结合成水,其余部分互相结合成酯,即酸去羟基醇去羟基氢,据此判断含有18O的化合物,并计算出生成的乙酸乙酯的相对分子量.
解答 解:A、C.乙酸与乙醇反应乙酸提供羟基,醇提供羟基氢原子,结合生成水,其余部分互相结合成酯,所以CH3CH218OH与乙酸反应方程式为:CH3COOH+CH3CH218OH CH3CO18OCH2CH3+H2O,由于酯化反应是可逆反应,故乙醇仍存在,18O只存在于乙醇和乙酸乙酯中,故A错误,C正确;
CH3CO18OCH2CH3+H2O,由于酯化反应是可逆反应,故乙醇仍存在,18O只存在于乙醇和乙酸乙酯中,故A错误,C正确;
B.酯化反应中浓硫酸起到催化剂和脱水剂的作用,故B正确;
D.与丙酸反应生成的酯为:CH3CH2CO18OCH2CH3,该酯的相对分子质量为104,故D正确;
故选A.
点评 本题考查有机物的结构和性质,侧重考查酯化反应的原理与特点,难度不大,注意羧酸跟醇的酯化反应是可逆的,羧酸跟醇的反应过程一般是:羧酸分子中的羟基与醇分子中羟基的氢原子结合成水,其余部分互相结合成酯.

练习册系列答案
相关题目
8.下列反应的化学方程式书写正确的是( )
| A. | 实验室制乙烯:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$ CH2=CH2↑+H2O | |
| B. | 苯酚钠溶液通入少量CO2:2 +CO2+H2O→2 +CO2+H2O→2 +Na2CO3 +Na2CO3 | |
| C. | 乙酸苯酚酯在足量的NaOH溶液中水解: +NaOH→CH3COONa+ +NaOH→CH3COONa+ | |
| D. | 工业制聚乙烯:nCH2=CH2 $\stackrel{催化剂}{→}$ |
9.乙醚是化工生产中重要的溶剂,也用作药物生产的萃取剂和医疗上的麻醉剂.实验室通过乙醇脱水制备:
【原理】2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O
(170℃时产生CH2═CH2,长时间加热还会发生脱水、氧化还原反应等)
【主要物质物理性质】
【装置】
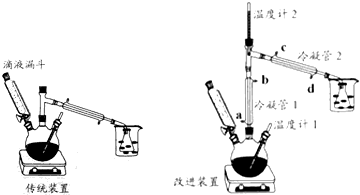
【实验步骤】
I、加浓硫酸和95%乙醇各12mL于三颈瓶中,并将三颈瓶浸入冰水中冷却,将25mL95%乙醇加入滴液漏斗,组装好仪器.
II、加热三颈瓶,使反应瓶温度迅速上升到140℃,然后开始慢慢滴加乙醇,控制合适的滴加速度,维持反应温度在135-145℃.
III、反应停止后,去掉热源,得粗产品.
IV、将粗产品转入仪器A,依次用8mL5%NaOH溶液、8mL试剂B、8mL(两次)饱和CaCl2溶液洗涤.
V、处理后的粗产品最后用无水氯化钙干燥至澄清,经操作C得到16.8g乙醚.
请回答:
(1)在步骤I中,向三颈瓶中加乙醇和浓硫酸的顺序是先加乙醇,再加浓硫酸.
(2)比较改进装置中两根冷凝管中水温的高低,如果用橡皮管将一个冷凝管的出水口接到另外一个冷凝管的进水口,有关说法和操作方法最合理的是B.
A、冷凝管1的水温相对高,水流方向为a→b→d→c
B、冷凝管1的水温相对高,水流方向为d→c→a→b
C、冷凝管2的水温相对高,水流方向为a→b→d→c
D、冷凝管2的水温相对高,水流方向为d→c→a→b
(3)反应过程中发现温度计1正常,温度计2的读数比预计温度高,为保证实验成功,可进行的操作是D.
A、适当加快滴液漏斗中乙醇的滴加速度 B、降低加热装置的加热温度
C、将温度计2拔高一点 D、加快冷凝管中水的流速
(4)改进装置能将产率提高50%,传统装置产率低的主要原因是传统装置中乙醇被大量蒸出,降低了产率.
(5)在步骤IV中,仪器A的名称是分液漏斗.
(6)在步骤IV中,用NaOH溶液时为了除去除去二氧化硫、二氧化碳,然后用试剂B洗涤NaOH,以免跟CaCl2产生沉淀,试剂B最好是饱和NaCl溶液(“乙醇”、“蒸馏水”、“饱和NaCl溶液”).
【原理】2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O
(170℃时产生CH2═CH2,长时间加热还会发生脱水、氧化还原反应等)
【主要物质物理性质】
| 物质 | 熔点℃ | 沸点℃ | 溶解性 | ||
| 水 | 醇 | 醚 | |||
| 浓硫酸 | 10.35 | 340 | 互溶 | 互溶 | 互溶 |
| 乙醚 | -89.12 | 34.5 | 微溶(在盐溶液中溶解度降低) | 互溶 | 互溶 |
| 乙醇 | -114.5 | 78.4 | 极易溶 | 极易溶 | 极易溶 |

【实验步骤】
I、加浓硫酸和95%乙醇各12mL于三颈瓶中,并将三颈瓶浸入冰水中冷却,将25mL95%乙醇加入滴液漏斗,组装好仪器.
II、加热三颈瓶,使反应瓶温度迅速上升到140℃,然后开始慢慢滴加乙醇,控制合适的滴加速度,维持反应温度在135-145℃.
III、反应停止后,去掉热源,得粗产品.
IV、将粗产品转入仪器A,依次用8mL5%NaOH溶液、8mL试剂B、8mL(两次)饱和CaCl2溶液洗涤.
V、处理后的粗产品最后用无水氯化钙干燥至澄清,经操作C得到16.8g乙醚.
请回答:
(1)在步骤I中,向三颈瓶中加乙醇和浓硫酸的顺序是先加乙醇,再加浓硫酸.
(2)比较改进装置中两根冷凝管中水温的高低,如果用橡皮管将一个冷凝管的出水口接到另外一个冷凝管的进水口,有关说法和操作方法最合理的是B.
A、冷凝管1的水温相对高,水流方向为a→b→d→c
B、冷凝管1的水温相对高,水流方向为d→c→a→b
C、冷凝管2的水温相对高,水流方向为a→b→d→c
D、冷凝管2的水温相对高,水流方向为d→c→a→b
(3)反应过程中发现温度计1正常,温度计2的读数比预计温度高,为保证实验成功,可进行的操作是D.
A、适当加快滴液漏斗中乙醇的滴加速度 B、降低加热装置的加热温度
C、将温度计2拔高一点 D、加快冷凝管中水的流速
(4)改进装置能将产率提高50%,传统装置产率低的主要原因是传统装置中乙醇被大量蒸出,降低了产率.
(5)在步骤IV中,仪器A的名称是分液漏斗.
(6)在步骤IV中,用NaOH溶液时为了除去除去二氧化硫、二氧化碳,然后用试剂B洗涤NaOH,以免跟CaCl2产生沉淀,试剂B最好是饱和NaCl溶液(“乙醇”、“蒸馏水”、“饱和NaCl溶液”).
6.下列有关电池的叙述正确的是( )
| A. | 锌锰干电池中,锌电极是负极 | |
| B. | 手机用的锂离子电池属于一次电池 | |
| C. | 太阳能电池的主要材料为二氧化硅 | |
| D. | 氢氧燃料电池工作时氢气在负极被还原 |
3.下列除去杂质的方法正确的是(括号内的是杂质)( )
| A. | N2(CO):通过灼热的CuO粉末 | B. | SO2 (HCl):通入饱和碳酸氢钠溶液中 | ||
| C. | NaCl(NH4Cl):加热 | D. | NO2(NO):通入水中 |
10.几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
| A. | 氢化物的沸点为H2T<H2X | |
| B. | R的氧化物对应的水化物可能具有两性 | |
| C. | X单质在氧气中燃烧生成XO3 | |
| D. | L、X形成的简单离子核外电子数相等 |
7.下列有关(NH4)2Fe(SO4)2溶液的叙述正确的是( )
| A. | 该溶液中,H+、Fe3+、Br-、NO3-可以大量共存 | |
| B. | 和足量的Ba(OH)2溶液反应的离子方程式:2NH4++Fe2++2SO42-+2Ba2++4OH-═2NH3•H2O+Fe(OH)2↓+2BaSO4↓ | |
| C. | 和KMnO4溶液反应后溶液可以褪为无色 | |
| D. | 该溶液与氢氧化钠溶液共热,产生的气体能使湿润的蓝色石蕊试纸变红 |
8.下列物质的描述和相关知识均正确的是( )
| 物质及变化 | 描述 | 相关知识 | |
| A | 碘化钾溶液滴到土豆片上 | 变蓝色 | 土豆片含淀粉 |
| B | 煤的气化 | 化学变化 | 主要反应是碳与水生成水煤气等 |
| C | 乙烯和苯 | 都能使溴水褪色 | 分子中含有相同的碳碳双键 |
| D | 蔗糖和麦芽糖 | 多糖 | 二者互为同分异构体 |
| A. | A | B. | B | C. | C | D. | D |