题目内容
4.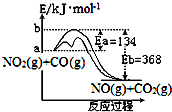 已知某反应的能量变化如图.在不同温度下,反应物初始浓度与初始反应速率有如表关系.
已知某反应的能量变化如图.在不同温度下,反应物初始浓度与初始反应速率有如表关系.| 实验序号 | 1 | 2 | 3 | 4 | |
| c(NO2)/mol•L-1 | 1 | 1 | 2 | 2 | |
| c(CO)/mol•L-1 | 1 | 2 | 1 | 2 | |
| v/mol•L-1•s-1 | 750K | p | 2p | 2p | 4p |
| 500K | q | q | 4q | 4q | |
| A. | 不同温度下,增加反应物的浓度不一定可以加快反应速率 | |
| B. | 加入催化剂,改变了反应的途径,加快了反应速率 | |
| C. | 升高反应温度,加快了反应速率,增大了平衡常数 | |
| D. | 750K时,将实验2的容器体积缩小一半,速率v为8p mol•L-1•s-1 |
分析 反应物总能量大于生成物总能量,正反应为放热反应,则升高温度,平衡逆向移动,升高温度、增大浓度、压强以及加入催化剂都可增大反应速率,以此解答该题.
解答 解:A.如降低温度,增大浓度,则反应速率不一定增大,故A正确;
B.加入催化剂,降低反应的活化能,改变了反应的途径,加快了反应速率,故B正确;
C.正反应为放热反应,升高温度,平衡逆向移动,则平衡常数减小,故C错误;
D.750K时,将实验2的容器体积缩小一半,NO2和CO浓度都增大一倍,由表中数据可知速率v为8p mol•L-1•s-1,故D正确.
故选C.
点评 本题考查化学平衡的建立以及反应速率的影响因素,为高频考点,侧重于学生的分析能力的考查,易错点为D,注意浓度与速率的关系,难度中等.

练习册系列答案
相关题目
19.下列每组内的三种物质中最后一种物质均为过量(充分反应后,该物质有剩余),分别向各组物质中加适量水,使它们充分反应后,静置、过滤,所得滤渣中有两种物质的是( )
| A. | CuCl2、Cu(NO3)2、Ba(OH)2 | B. | Al、Fe、CuSO4 | ||
| C. | MgSO4、Mg(NO3)2、Ba(OH)2 | D. | Al、Cu、FeSO4 |
12.下列关于醛的说法中正确的是( )
| A. | 所有醛中都含醛基和烃基 | |
| B. | 一元醛的分子式符合CnH2nO的通式 | |
| C. | 醛的官能团是-COH | |
| D. | 所有醛都能使溴水和酸性KMnO4溶液褪色 |
9.乙醚是化工生产中重要的溶剂,也用作药物生产的萃取剂和医疗上的麻醉剂.实验室通过乙醇脱水制备:
【原理】2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O
(170℃时产生CH2═CH2,长时间加热还会发生脱水、氧化还原反应等)
【主要物质物理性质】
【装置】
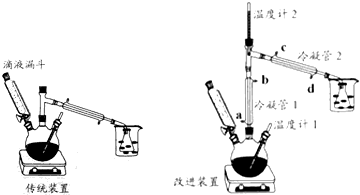
【实验步骤】
I、加浓硫酸和95%乙醇各12mL于三颈瓶中,并将三颈瓶浸入冰水中冷却,将25mL95%乙醇加入滴液漏斗,组装好仪器.
II、加热三颈瓶,使反应瓶温度迅速上升到140℃,然后开始慢慢滴加乙醇,控制合适的滴加速度,维持反应温度在135-145℃.
III、反应停止后,去掉热源,得粗产品.
IV、将粗产品转入仪器A,依次用8mL5%NaOH溶液、8mL试剂B、8mL(两次)饱和CaCl2溶液洗涤.
V、处理后的粗产品最后用无水氯化钙干燥至澄清,经操作C得到16.8g乙醚.
请回答:
(1)在步骤I中,向三颈瓶中加乙醇和浓硫酸的顺序是先加乙醇,再加浓硫酸.
(2)比较改进装置中两根冷凝管中水温的高低,如果用橡皮管将一个冷凝管的出水口接到另外一个冷凝管的进水口,有关说法和操作方法最合理的是B.
A、冷凝管1的水温相对高,水流方向为a→b→d→c
B、冷凝管1的水温相对高,水流方向为d→c→a→b
C、冷凝管2的水温相对高,水流方向为a→b→d→c
D、冷凝管2的水温相对高,水流方向为d→c→a→b
(3)反应过程中发现温度计1正常,温度计2的读数比预计温度高,为保证实验成功,可进行的操作是D.
A、适当加快滴液漏斗中乙醇的滴加速度 B、降低加热装置的加热温度
C、将温度计2拔高一点 D、加快冷凝管中水的流速
(4)改进装置能将产率提高50%,传统装置产率低的主要原因是传统装置中乙醇被大量蒸出,降低了产率.
(5)在步骤IV中,仪器A的名称是分液漏斗.
(6)在步骤IV中,用NaOH溶液时为了除去除去二氧化硫、二氧化碳,然后用试剂B洗涤NaOH,以免跟CaCl2产生沉淀,试剂B最好是饱和NaCl溶液(“乙醇”、“蒸馏水”、“饱和NaCl溶液”).
【原理】2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O
(170℃时产生CH2═CH2,长时间加热还会发生脱水、氧化还原反应等)
【主要物质物理性质】
| 物质 | 熔点℃ | 沸点℃ | 溶解性 | ||
| 水 | 醇 | 醚 | |||
| 浓硫酸 | 10.35 | 340 | 互溶 | 互溶 | 互溶 |
| 乙醚 | -89.12 | 34.5 | 微溶(在盐溶液中溶解度降低) | 互溶 | 互溶 |
| 乙醇 | -114.5 | 78.4 | 极易溶 | 极易溶 | 极易溶 |

【实验步骤】
I、加浓硫酸和95%乙醇各12mL于三颈瓶中,并将三颈瓶浸入冰水中冷却,将25mL95%乙醇加入滴液漏斗,组装好仪器.
II、加热三颈瓶,使反应瓶温度迅速上升到140℃,然后开始慢慢滴加乙醇,控制合适的滴加速度,维持反应温度在135-145℃.
III、反应停止后,去掉热源,得粗产品.
IV、将粗产品转入仪器A,依次用8mL5%NaOH溶液、8mL试剂B、8mL(两次)饱和CaCl2溶液洗涤.
V、处理后的粗产品最后用无水氯化钙干燥至澄清,经操作C得到16.8g乙醚.
请回答:
(1)在步骤I中,向三颈瓶中加乙醇和浓硫酸的顺序是先加乙醇,再加浓硫酸.
(2)比较改进装置中两根冷凝管中水温的高低,如果用橡皮管将一个冷凝管的出水口接到另外一个冷凝管的进水口,有关说法和操作方法最合理的是B.
A、冷凝管1的水温相对高,水流方向为a→b→d→c
B、冷凝管1的水温相对高,水流方向为d→c→a→b
C、冷凝管2的水温相对高,水流方向为a→b→d→c
D、冷凝管2的水温相对高,水流方向为d→c→a→b
(3)反应过程中发现温度计1正常,温度计2的读数比预计温度高,为保证实验成功,可进行的操作是D.
A、适当加快滴液漏斗中乙醇的滴加速度 B、降低加热装置的加热温度
C、将温度计2拔高一点 D、加快冷凝管中水的流速
(4)改进装置能将产率提高50%,传统装置产率低的主要原因是传统装置中乙醇被大量蒸出,降低了产率.
(5)在步骤IV中,仪器A的名称是分液漏斗.
(6)在步骤IV中,用NaOH溶液时为了除去除去二氧化硫、二氧化碳,然后用试剂B洗涤NaOH,以免跟CaCl2产生沉淀,试剂B最好是饱和NaCl溶液(“乙醇”、“蒸馏水”、“饱和NaCl溶液”).
16.下列反应的离子方程式正确的是( )
| A. | 向NaOH溶液中加入铝粉来制备H2:Al+2OH-+2H2O═AlO2-+3H2↑ | |
| B. | 碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 实验室用氢氧化钠溶液吸收Cl2:Cl2+OH-═Cl-+ClO-+H2O | |
| D. | 用胃舒平治疗胃酸过多:Al(OH)3+3H+═Al3++3H2O |
14.下列实验能达到目的是( )
| A. | 将NH4Cl溶液蒸干灼烧制备NH4Cl固体 | |
| B. | 只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 | |
| C. | 用可见光束照射以区别溶液和胶体 | |
| D. | 用分液的方法分离酒精和水的混合物 |