题目内容
3.制造导弹的雷达罩和宇航员使用的氧气瓶的主要材料是透明聚酯玻璃钢,制备它的一种配方中含有下列四种物质:
填写下列空白:
(1)甲中不含氧原子的官能团是碳碳双键;甲分子无(填“有”或“无”)顺反异构现象.
(2)下列试剂能与甲反应而褪色的是(填标号)ac.
A.Br2/CCl4溶液 B.石蕊溶液 C.酸性KMnO4溶液
(3)写出乙与乙二酸反应的化学方程式nHOCH2CH2OH+nHOOC-COOH

 +(2n-1)H2O.有机物乙在水中的溶解情况是易溶于水(填“不溶于水”、“微溶于水”、“易溶于水”).
+(2n-1)H2O.有机物乙在水中的溶解情况是易溶于水(填“不溶于水”、“微溶于水”、“易溶于水”).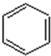 +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$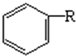
 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$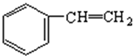 +H2
+H2(4)已知:利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程
式是:
 .
.(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为94.丁与FeCl3溶液作用显现特征颜色.则丁与浓溴水能否反应?
 .(如不能发生反应,请填“否”;如能发生反应请写出其反应的方程式)
.(如不能发生反应,请填“否”;如能发生反应请写出其反应的方程式)
分析 (1)甲中含C=C和-COOC-,C=C上其中一个C连2个相同的原子H;
(2)甲含有碳碳三键,可发生加成、氧化反应;含有酯基,可发生水解反应;
(3)乙二醇含有羟基,可与水形成氢键,易溶于水,可与乙二酸发生酯化反应,缩聚反应等;
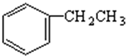
(4)以苯、乙烯、氯化氢为原料经三步反应合成丙,乙烯加成生成氯乙烷,苯与氯乙烷发生取代反应生成苯乙烷,最后消去生成丙;
(5)苯酚含有酚羟基,可与溴水发生取代反应生成三溴苯酚,以此解答,
解答 解:(1)甲中含C=C和-COOC-,不含氧原子的官能团名称是碳碳双键,C=C上其中一个C连2个相同的原子H,则无顺反异构现象,
故答案为:碳碳双键;无;
(2)甲中含C=C,与溴发生加成反应,可被高锰酸钾氧化,则能与甲反应而褪色的是ac,故答案为:ac;
(3)乙二醇含有羟基,可与水形成氢键,易溶于水,可与乙二酸发生酯化反应,缩聚反应等,如发生n HOCH2CH2OH+nHOOC-COOH
 +(2n-1)H2O,
+(2n-1)H2O,
故答案为:n HOCH2CH2OH+nHOOC-COOH
 +(2n-1)H2O;易溶于水;
+(2n-1)H2O;易溶于水;
(4)发生反应分别为CH2=CH2+HCl→CH3CH2Cl、 、
、 ,
,
其中属于取代反应的为 ,故答案为:
,故答案为: ;
;
(5)苯酚含有酚羟基,可与溴水发生取代反应生成三溴苯酚,方程式为 ,
,
故答案为: .
.
点评 本题考查有机物的合成与推断,侧重于有机物官能团的性质的考查,为高考常见题型,难度不大,注意把握有机物官能团的性质.

练习册系列答案
相关题目
14.下列实验能达到目的是( )
| A. | 将NH4Cl溶液蒸干灼烧制备NH4Cl固体 | |
| B. | 只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 | |
| C. | 用可见光束照射以区别溶液和胶体 | |
| D. | 用分液的方法分离酒精和水的混合物 |
11.如表为元素周期表的一部分.X、Y、Z、W为短周期元素,其中X元素的原子最外层电子数是其内层电子数的2倍.下列说法正确的是( )
| X | Y | ||
| Z | W | ||
| T |
| A. | 根据元素周期律,可以推测存在T3Y4、TZ2和TW4 | |
| B. | W的氧化物的水化物酸性一定比Z的强 | |
| C. | XZ2、XW4与YW3都是非极性分子 | |
| D. | X氢化物的沸点一定比Y氢化物的沸点低 |
18.生产、生活中处处有化学,下列有关说法正确的是( )
| A. | 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料 | |
| B. | 某雨水样品放置一段时间后,PH由4.68变为4.00,是因为水中溶解的CO2增多 | |
| C. | 在结冰的路面上撒盐,是利用盐与水发生化学反应放出大量热量,促使冰雪融化 | |
| D. | 人类对于能源的利用大致可以分为三个时代:柴草能源、化石能源、多能源时代,目前,全球已主要处于多能源时代 |
8.下列物质的描述和相关知识均正确的是( )
| 物质及变化 | 描述 | 相关知识 | |
| A | 碘化钾溶液滴到土豆片上 | 变蓝色 | 土豆片含淀粉 |
| B | 煤的气化 | 化学变化 | 主要反应是碳与水生成水煤气等 |
| C | 乙烯和苯 | 都能使溴水褪色 | 分子中含有相同的碳碳双键 |
| D | 蔗糖和麦芽糖 | 多糖 | 二者互为同分异构体 |
| A. | A | B. | B | C. | C | D. | D |
15.下列有关化学用语的表示方法中正确的是( )
| A. | H2O2的电子式: | |
| B. | CO2分子的结构式:O═C═O | |
| C. | 原子核内有8个中子的碳原子:${\;}_8^{14}C$ | |
| D. | 氯化钾的分子式:KCl |
12.下列关于卤素的说法中,正确的是( )
| A. | 单质的密度随核电荷数的增加逐渐减小 | |
| B. | 单质的颜色随核电荷数的增加而逐渐变浅 | |
| C. | 单质的氧化性随核电荷数的增加而逐渐减弱 | |
| D. | 氢化物的稳定性随核电荷数的增加逐渐增强 |
6.已知弱酸的电离平衡常数如下表:下列选项正确的是( )
| 弱酸 | H2CO3 | 水杨酸(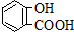 ) ) |
| 电离平衡常数(25℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-11 |
| A. | 常温下,等浓度、等体积的NaHCO3溶液pH小于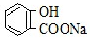 溶液pH 溶液pH | |
| B. | 常温下,等浓度、等体积的Na2CO3溶液和  溶液中所含离子总数前者小于后者 溶液中所含离子总数前者小于后者 | |
| C. |  +2NaHCO3→ +2NaHCO3→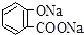 +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. |  最多可与2molCO2反应 最多可与2molCO2反应 |