题目内容
化学研究性学习小组对放置己久的小苏打进行探究.请完成下列探究报告.
(1)探究小苏打是否已经变质的实验方法是取样溶解,再
A.加Ca(OH)2溶液 B.加CaCl2溶液 C.逐滴滴加稀盐酸
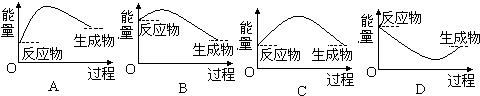
(2)设计如下实验方案,测定样品中纯碱的质量分数.方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算.实验中加热至恒重时发生的化学反应方程式 .与该反应对应的能量变化关系图是下图中的
方案二:按下图装置进行实验.并回答以下问题.
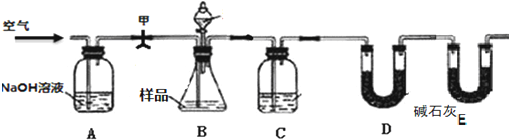
实验步骤:
①如上图所示连接好装置,先 ;
②准确称取样品的质量19.0g,并在各仪器中加入相应试剂如分液漏斗中应该装 (“盐酸”或“硫酸”).
③打开弹簧夹甲,缓缓通入空气;
④打开B的分液漏斗滴加酸反应;
⑤待B中不再产生气体后停止滴加酸,同时再次持续缓缓通入空气;E装置的作用是 ;步骤⑤中还要再通空气的原因是 ;实验中除称量样品质量外,还需称 装置(填字母)前后质量的变化,若该装置增重8.8g,样品中碳酸钠的质量分数为 .
方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液.过滤洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯,漏斗外,还用到的玻璃仪器有 .
②实验中判断沉淀是否完全的方法是 .
③已知称得样品19g,干燥得沉淀质量为19.7g,则样品中原小苏打的质量应为 g.
(1)探究小苏打是否已经变质的实验方法是取样溶解,再
A.加Ca(OH)2溶液 B.加CaCl2溶液 C.逐滴滴加稀盐酸
(2)设计如下实验方案,测定样品中纯碱的质量分数.方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算.实验中加热至恒重时发生的化学反应方程式

方案二:按下图装置进行实验.并回答以下问题.

实验步骤:
①如上图所示连接好装置,先
②准确称取样品的质量19.0g,并在各仪器中加入相应试剂如分液漏斗中应该装
③打开弹簧夹甲,缓缓通入空气;
④打开B的分液漏斗滴加酸反应;
⑤待B中不再产生气体后停止滴加酸,同时再次持续缓缓通入空气;E装置的作用是
方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液.过滤洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯,漏斗外,还用到的玻璃仪器有
②实验中判断沉淀是否完全的方法是
③已知称得样品19g,干燥得沉淀质量为19.7g,则样品中原小苏打的质量应为
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)小苏打变质后生成的杂质是碳酸钠,因此检验是否变质即检验是否存在碳酸根离子,据此进行分析解答;
A.澄清石灰水跟二者都能反应,现象都是白色沉淀生成,无法区别是否含有碳酸钠;
B.碳酸氢钠与氯化钙不反应,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠;
C.碳酸钠和碳酸氢钠与盐酸反应生成二氧化碳和水,无法区别是否含有碳酸钠;
(2)方案一:该方案原理为在加热的条件下Na2CO3能够稳定存在,而NaHCO3较易发生如下的分解反应2NaHCO3=Na2CO3+CO2↑+H2O,从而可根据其反应产生的CO2和水蒸汽H2O的量或残留的固体的量推算出小苏打样品中纯碱的质量分数.该方案根据加热后残渣的质量来求解,方案关键是要加热至恒重,以保证NaHCO3全部分解,碳酸氢钠不稳定,受热易分解,分解反应通常为吸热反应;
方案二:打开弹簧夹甲,缓缓通入空气进入装置A中,二氧化碳被氢氧化钠吸收,剩余气体通过各装置排净装置中的二氧化碳,避免干扰实验,打开B的分液漏斗滴加酸反应,装置B中发生Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑,C中为浓硫酸吸收水,干燥二氧化碳,利用D装置吸收二氧化碳,E装置防止空气中的二氧化碳、水进入D装置干扰含量测定.方案关键是要获得产生的CO2的质量.
①通过反应生成气体检验小苏打是否变质,防止装置漏气,首先须检查装置的气密性;
②盐酸易挥发,硫酸难挥发,据此分析判断;
⑤E装置的作用是防止空气中的水蒸气、二氧化碳进入D被吸收;步骤⑤中还要再通空气,将装置B、C中的二氧化碳全部排入D中;根据Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑列式求解;
方案三:该方案原理为在样品中加入BaCl2溶液,其中Na2CO3可与BaCl2发生反应Na2CO3+BaCl2=BaCO3↓+2NaCl,而NaHCO3与BaCl2则不反应.从而根擗产生的沉淀量,得出纯碱的质量分数.方案关键是测定BaCO3沉淀的质量,自然要保证沉淀完全,要正确过滤好.
①根据过滤具体操作判断所需仪器;
②试验中判断沉淀是否完全的方法是:取少量滤液,再滴加BaCl2溶液少许,如无白色沉淀出现,说明沉淀完全;
③在一定量样品中加入足量氯化钡溶液,碳酸氢钠与氯化钡不反应,碳酸钠和氯化钡此时发生如下反应:Na2CO3+BaCl2═BaCO3↓+2NaCl,产生BaCO3沉淀,根据样品的总量和生成BaCO3沉淀的量结合2NaHCO3
Na2CO3+H2O+CO2↑,就可得出原小苏打的质量;
A.澄清石灰水跟二者都能反应,现象都是白色沉淀生成,无法区别是否含有碳酸钠;
B.碳酸氢钠与氯化钙不反应,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠;
C.碳酸钠和碳酸氢钠与盐酸反应生成二氧化碳和水,无法区别是否含有碳酸钠;
(2)方案一:该方案原理为在加热的条件下Na2CO3能够稳定存在,而NaHCO3较易发生如下的分解反应2NaHCO3=Na2CO3+CO2↑+H2O,从而可根据其反应产生的CO2和水蒸汽H2O的量或残留的固体的量推算出小苏打样品中纯碱的质量分数.该方案根据加热后残渣的质量来求解,方案关键是要加热至恒重,以保证NaHCO3全部分解,碳酸氢钠不稳定,受热易分解,分解反应通常为吸热反应;
方案二:打开弹簧夹甲,缓缓通入空气进入装置A中,二氧化碳被氢氧化钠吸收,剩余气体通过各装置排净装置中的二氧化碳,避免干扰实验,打开B的分液漏斗滴加酸反应,装置B中发生Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑,C中为浓硫酸吸收水,干燥二氧化碳,利用D装置吸收二氧化碳,E装置防止空气中的二氧化碳、水进入D装置干扰含量测定.方案关键是要获得产生的CO2的质量.
①通过反应生成气体检验小苏打是否变质,防止装置漏气,首先须检查装置的气密性;
②盐酸易挥发,硫酸难挥发,据此分析判断;
⑤E装置的作用是防止空气中的水蒸气、二氧化碳进入D被吸收;步骤⑤中还要再通空气,将装置B、C中的二氧化碳全部排入D中;根据Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑列式求解;
方案三:该方案原理为在样品中加入BaCl2溶液,其中Na2CO3可与BaCl2发生反应Na2CO3+BaCl2=BaCO3↓+2NaCl,而NaHCO3与BaCl2则不反应.从而根擗产生的沉淀量,得出纯碱的质量分数.方案关键是测定BaCO3沉淀的质量,自然要保证沉淀完全,要正确过滤好.
①根据过滤具体操作判断所需仪器;
②试验中判断沉淀是否完全的方法是:取少量滤液,再滴加BaCl2溶液少许,如无白色沉淀出现,说明沉淀完全;
③在一定量样品中加入足量氯化钡溶液,碳酸氢钠与氯化钡不反应,碳酸钠和氯化钡此时发生如下反应:Na2CO3+BaCl2═BaCO3↓+2NaCl,产生BaCO3沉淀,根据样品的总量和生成BaCO3沉淀的量结合2NaHCO3
| ||
解答:
解:(1)小苏打的成分为碳酸氢钠,小苏打变质分解为碳酸钠,因此检验是否变质即检验是否存在碳酸根离子,
A.澄清石灰水跟二者都能反应,Ca(OH)2+Na2CO3═CaCO3↓+2NaOH,Ca(OH)2+NaHCO3═CaCO3↓+NaOH+H2O均生成白色沉淀,无法区别是否含有碳酸钠,故A错误;
B. 碳酸氢钠与氯化钙不反应,碳酸钠与氯化钙反应Na2CO3+CaCl2=CaCO3↓+2NaCl生成碳酸钙沉淀,可鉴别小苏打是否已经变质,故B正确;
C.碳酸氢钠中无论是否含有碳酸钠,逐滴滴加稀盐酸,都有二氧化碳气体生成,无法鉴别,故C错误;
故选B.
(2)方案一:称取一定质量的样品,置于坩埚中加热至恒重,以保证NaHCO3全部分解,发生的化学反应方程式为:2NaHCO3
Na2CO3+H2O+CO2↑,分解反应通常为吸热反应,该反应为分解反应为吸热反应,反应中生成物总能量高于反应物总能量,需从外界吸收能量贮存,故A符合,
故答案为:2NaHCO3
Na2CO3+H2O+CO2↑;A;
方案二:打开弹簧夹甲,缓缓通入空气进入装置A中,二氧化碳被氢氧化钠吸收,剩余气体通过各装置排净装置中的二氧化碳,避免干扰实验,打开B的分液漏斗滴加酸反应,装置B中发生Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑,C中为浓硫酸吸收水,干燥二氧化碳,利用D装置吸收二氧化碳,E装置防止空气中的二氧化碳、水进入D装置干扰含量测定.
①通过反应生成气体的量检验小苏打是否变质,为了保证实验的成功,首先须检查装置的气密性,
故答案为:检查装置的气密性;
②该实验通过D装置吸收二氧化碳的量测定小苏打是否变质,盐酸易挥发,如用盐酸,生成的二氧化碳中混有氯化氢,影响测定结果,所以分液漏斗中应该装硫酸,
故答案为:硫酸;
⑤E装置的作用是防止空气中的水蒸气、二氧化碳进入D被吸收;步骤⑤中还要再通空气,将装置B、C中的二氧化碳全部排入D中;
设19.0g样品中NaHCO3和Na2CO3的物质的量分别为x、y,则
Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
x x y y
解得x=0.1mol,则样品中Na2CO3的质量分数
×100%≈55.8%,
故答案为:55.8%;
方案三:①过滤操作中,除了烧杯、漏斗外还用到玻璃棒引流,
故答案为:玻璃棒;
②试验中判断沉淀是否完全的方法是:取上层清液,再滴加BaCl2溶液少许,如无白色沉淀出现,说明沉淀完全,
故答案为:取上层清液中滴加氯化钡溶液,如无沉淀生成则沉淀完全;
③在一定量样品中加入足量氯化钡溶液,碳酸氢钠与氯化钡不反应,碳酸钠和氯化钡此时发生如下反应:Na2CO3+BaCl2═BaCO3↓+2NaCl,产生BaCO3沉淀,干燥得沉淀质量为19.7g,n(BaCO3)=
=
=0.1mol,n(BaCO3)=n(Na2CO3),碳酸钠的质量为m(Na2CO3)=nM=0.1mol×106g/mol=10.6g,则样品中m(NaHCO3)=19g-10.6g=8.4g,则原样品中转变为碳酸钠的原小苏打n(NaHCO3)=2n(Na2CO3)=0.2mol,质量应为m(NaHCO3)=nM=0.2mol×84g/mol=16.8g,则样品中原小苏打的质量应为16.8g+8.4g=25.2g,
故答案为:25.2g;
A.澄清石灰水跟二者都能反应,Ca(OH)2+Na2CO3═CaCO3↓+2NaOH,Ca(OH)2+NaHCO3═CaCO3↓+NaOH+H2O均生成白色沉淀,无法区别是否含有碳酸钠,故A错误;
B. 碳酸氢钠与氯化钙不反应,碳酸钠与氯化钙反应Na2CO3+CaCl2=CaCO3↓+2NaCl生成碳酸钙沉淀,可鉴别小苏打是否已经变质,故B正确;
C.碳酸氢钠中无论是否含有碳酸钠,逐滴滴加稀盐酸,都有二氧化碳气体生成,无法鉴别,故C错误;
故选B.
(2)方案一:称取一定质量的样品,置于坩埚中加热至恒重,以保证NaHCO3全部分解,发生的化学反应方程式为:2NaHCO3
| ||
故答案为:2NaHCO3
| ||
方案二:打开弹簧夹甲,缓缓通入空气进入装置A中,二氧化碳被氢氧化钠吸收,剩余气体通过各装置排净装置中的二氧化碳,避免干扰实验,打开B的分液漏斗滴加酸反应,装置B中发生Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑,C中为浓硫酸吸收水,干燥二氧化碳,利用D装置吸收二氧化碳,E装置防止空气中的二氧化碳、水进入D装置干扰含量测定.
①通过反应生成气体的量检验小苏打是否变质,为了保证实验的成功,首先须检查装置的气密性,
故答案为:检查装置的气密性;
②该实验通过D装置吸收二氧化碳的量测定小苏打是否变质,盐酸易挥发,如用盐酸,生成的二氧化碳中混有氯化氢,影响测定结果,所以分液漏斗中应该装硫酸,
故答案为:硫酸;
⑤E装置的作用是防止空气中的水蒸气、二氧化碳进入D被吸收;步骤⑤中还要再通空气,将装置B、C中的二氧化碳全部排入D中;
设19.0g样品中NaHCO3和Na2CO3的物质的量分别为x、y,则
Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
x x y y
|
| 0.1mol×106g/mol |
| 19g |
故答案为:55.8%;
方案三:①过滤操作中,除了烧杯、漏斗外还用到玻璃棒引流,
故答案为:玻璃棒;
②试验中判断沉淀是否完全的方法是:取上层清液,再滴加BaCl2溶液少许,如无白色沉淀出现,说明沉淀完全,
故答案为:取上层清液中滴加氯化钡溶液,如无沉淀生成则沉淀完全;
③在一定量样品中加入足量氯化钡溶液,碳酸氢钠与氯化钡不反应,碳酸钠和氯化钡此时发生如下反应:Na2CO3+BaCl2═BaCO3↓+2NaCl,产生BaCO3沉淀,干燥得沉淀质量为19.7g,n(BaCO3)=
| m |
| M |
| 19.7g |
| 197g/mol |
故答案为:25.2g;
点评:本题以实验探究“测定放置已久的小苏打样品中纯碱的质量分数”为载体,考查学生对于实验原理与装置理解评价、实验基本操作、化学计算等,为高频考点,题目涉及到的小苏打和纯碱的化学知识是多方面的,构成了一道多角度的探究题,把握实验装置的作用及实验目的为解答的关键,注意方案三:③求样品中原小苏打的质量为原样品中转变为碳酸钠的原小苏打和现小苏打和,题目难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、元素的非金属性越强,它的氧化物的水化物的酸性就越强 |
| B、同一主族元素的原子序数可以相差34 |
| C、硅和硫熔化时所克服的作用类型相同 |
| D、分子晶体中分子间作用力越大,沸点越高,分子越稳定 |
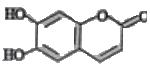 中药狼把草的成分之一M具有清炎杀菌作用,M的结构如右图所示:下列叙述正确的是( )
中药狼把草的成分之一M具有清炎杀菌作用,M的结构如右图所示:下列叙述正确的是( )| A、M既能与H2发生加成反应又能使酸性KMnO4溶液褪色 |
| B、1 mol M最多能与2mol Br2发生反应 |
| C、M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 |
| D、M既能与FeCl3溶液发生显色反应又能与NaHCO3反应放出CO2 |
 工业合成氨时将N2和H2按体积比为1:3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表:
工业合成氨时将N2和H2按体积比为1:3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表: