题目内容
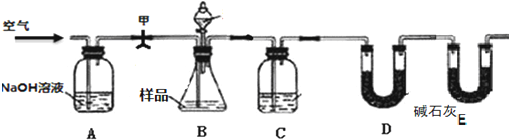
某研究性学习小组为测定NH3分子中氮、氢原子个数比,设计如图1实验流程:
实验时,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.
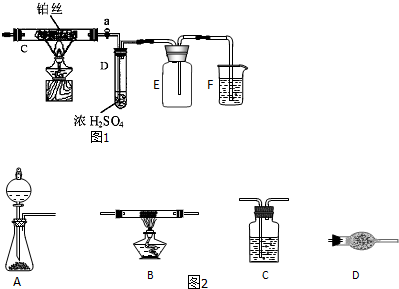
如图2中A、B、C为该小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶.请回答下列问题:
(1)写出仪器的名称:a ,b .
(2)硬质玻璃管中发生的反应方程式是 ,反应过程中硬质玻璃管的现象是 .
(3)请判断制取氨气可能用到的装置,如图3中你认为可行的装置中填写对应的实验药品(写出化学式).
(4)实验时洗气瓶D中的浓硫酸表现 性;该小组实验测得:洗气前装置D的质量为m1g、洗气后装置D的质量为m2g、生成的氮气在标准状况下的体积为V L.根据该小组计算NH3分子中氮、氢的原子个数比的表达式,请预计该结果与理论值相比, .
A.在实验误差范围内数值接近理论值 B.数值偏高 C.数值偏低.

实验时,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.
如图2中A、B、C为该小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶.请回答下列问题:
(1)写出仪器的名称:a
(2)硬质玻璃管中发生的反应方程式是
(3)请判断制取氨气可能用到的装置,如图3中你认为可行的装置中填写对应的实验药品(写出化学式).
(4)实验时洗气瓶D中的浓硫酸表现
A.在实验误差范围内数值接近理论值 B.数值偏高 C.数值偏低.
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)根据图示写出实验仪器;
(2)硬质玻璃管中,氨气还原氧化铜生成铜;
(3)根据复分解反应的特点及书写方程式的原则写出化学方程式;依据试剂特点和反应生成产物选择装置;利用氢氧化钠固体溶解放热促进氨水溶液中平衡向放氨气的方向进行;
(4)根据浓硫酸的吸水性及能与氨气反应进行分析.
(2)硬质玻璃管中,氨气还原氧化铜生成铜;
(3)根据复分解反应的特点及书写方程式的原则写出化学方程式;依据试剂特点和反应生成产物选择装置;利用氢氧化钠固体溶解放热促进氨水溶液中平衡向放氨气的方向进行;
(4)根据浓硫酸的吸水性及能与氨气反应进行分析.
解答:
解:(1)由图2可知,仪器a是圆底烧瓶;仪器b是分液漏斗,
故答案为:圆底烧瓶;分液漏斗;
(2)硬质玻璃管中,氨气还原氧化铜生成铜,黑色CuO固体变成红色Cu;
故答案为:湿润的红色石蕊试纸靠近试管口,试纸变蓝;
(3)A小组:氢氧化钙与硫酸铵反应生成硫酸钙、氨气和水,反应的化学方程式为(NH4)2SO4+Ca(OH)2
2NH3↑+2H2O+CaSO4;
B小组:浓氨水是液体,氢氧化钠是固体,为使氨气逸出,把氨水滴入固体氢氧化钠中,随着氢氧化钠溶解放热,氨气挥发放出气体;
故答案为:
;
(4)乙小组用所测数据计算出氨分子中氮、氢的原子个数比小于理论值,其原因是洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高. 因此在 洗气瓶D前的位置应增加了一个装有碱石灰(无水硫酸铜、氢氧化钠、氧化钙等)的实验仪器只吸收水,减小误差,
故答案为:吸水和酸;C.
故答案为:圆底烧瓶;分液漏斗;
(2)硬质玻璃管中,氨气还原氧化铜生成铜,黑色CuO固体变成红色Cu;
故答案为:湿润的红色石蕊试纸靠近试管口,试纸变蓝;
(3)A小组:氢氧化钙与硫酸铵反应生成硫酸钙、氨气和水,反应的化学方程式为(NH4)2SO4+Ca(OH)2
| ||
B小组:浓氨水是液体,氢氧化钠是固体,为使氨气逸出,把氨水滴入固体氢氧化钠中,随着氢氧化钠溶解放热,氨气挥发放出气体;
故答案为:
| 装置 | 实验药品 |
| A | NH4Cl、Ca(OH)2 |
| B | b:NH3?H2O(aq) a:CaO或 NaOH或CaO、NaOH |
(4)乙小组用所测数据计算出氨分子中氮、氢的原子个数比小于理论值,其原因是洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高. 因此在 洗气瓶D前的位置应增加了一个装有碱石灰(无水硫酸铜、氢氧化钠、氧化钙等)的实验仪器只吸收水,减小误差,
故答案为:吸水和酸;C.
点评:本题是一道综合性很强的实验探究题,要求学生具有分析和解决问题的能力,主要是物质探究物质组成和方法的应用,难度较大,搞清楚实验原理是解题的关键.

练习册系列答案
相关题目
下列物质的化学用语正确的是( )
①NH4H的电子式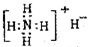
②硝基苯的结构简式:
③葡萄糖的实验式:CH2O
④甲烷分子的比例模型: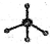
⑤Fe2+的离子结构:
⑥原子核内有10个中子的氧原子:
O.
①NH4H的电子式
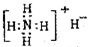
②硝基苯的结构简式:

③葡萄糖的实验式:CH2O
④甲烷分子的比例模型:

⑤Fe2+的离子结构:

⑥原子核内有10个中子的氧原子:
18 8 |
| A、②③⑥ | B、①③⑤⑥ |
| C、③⑥ | D、①②③④⑤⑥ |
温度为t℃,压强为1.01×106Pa的条件下,某密闭容器内,下列反应达到化学平衡:A(g)+B(g)?3C,测得此时c(A)=0.022mol?L-1;压缩容器使压强增大到2.02×106Pa,第二次达到平衡时,测得c(A)=0.05mol?L-1;若继续压缩容器,使压强增大到4.04×107Pa,第三次达到平衡时,测得c(A)=0.75mol?L-1;则下列关于C物质状态的推测正确的是( )
| A、C为非气态 |
| B、C为气态 |
| C、第二次达到平衡时C为气态 |
| D、第三次达到平衡时C为气态 |
下列对有机物结构或性质的描述,错误的是( )
| A、2-甲基-2-丁烯不存在顺反异构体 |
| B、羟基(-OH)和氢氧根(OH)的电子数相同 |
| C、苯酚钠溶液中通入CO2生成苯酚,则苯酚的酸性比碳酸弱 |
| D、光照下2,2-二甲基丙烷与Br2反应,其一溴取代物只有一种 |

 由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去).
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去).